
����Ŀ�����º�ѹ�£���һ���ݻ��ɱ���ܱ������з�����Ӧ��A(g)��B(g)![]() C(g)������ʼʱͨ��1molA��1molB���ﵽƽ��ʱ����amolC��������˵���������( )
C(g)������ʼʱͨ��1molA��1molB���ﵽƽ��ʱ����amolC��������˵���������( )
A. ����ʼʱͨ��3molA��3molB���ﵽƽ��ʱ�����ɵ�C�����ʵ���Ϊ3amol
B. ����ʼʱͨ��4molA��4molB��2molC���ﵽƽ��ʱ��B�����ʵ���һ������4mol
C. ����ʼʱͨ��2molA��2molB��1molC���ﵽƽ��ʱ����ͨ��3molC�����ٴδﵽƽ���C�����ʵ�������Ϊa/(2-a)
D. ����ԭƽ����ϵ�У���ͨ��1molA��1molB����������ƽ����Է�����������
���𰸡�B
��������
����A�����º�ѹ�£���ʼʱͨ��3 molA��3mol B�뿪ʼʱͨ��1molA��1molB��A��B�����ʵ���֮�ȶ���1��1��Ϊ��Чƽ�⣬��Ӧ���ת������ͬ���ʴﵽƽ��ʱ�����ɵ�C�����ʵ���Ϊ3amol��A��ȷ��B����ʼʱͨ��4 mol A��4 mol B��2 mol C�����ܴ���ƽ��״̬������������Ӧ���У��������淴Ӧ���У��ʴﵽƽ��ʱ��B�����ʵ������ܵ��ڡ�С�ڻ����4 mol��B����C������ʼʱͨ��2molA��2molB��1molC���ﵽƽ��ʱ����ͨ��3molC����ЧΪ��ʼͨ��6molA��6molB���뿪ʼʱͨ��1molA��1molBΪ��Чƽ�⣬C�ĺ�����ͬ����A��g��+B��g��![]() C��g����֪������amolC��������������ʵ�������amol����C�����ʵ�������Ϊ
C��g����֪������amolC��������������ʵ�������amol����C�����ʵ�������Ϊ![]() ��C��ȷ��D������ԭƽ����ϵ�У���ͨ��1molA��1molB����ЧΪ��ʼʱͨ��2molA��2molB����ԭƽ��Ϊ��Чƽ�⣬ƽ��ʱ����ֵĺ������䣬��������ƽ����Է����������䣬D��ȷ����ѡB��
��C��ȷ��D������ԭƽ����ϵ�У���ͨ��1molA��1molB����ЧΪ��ʼʱͨ��2molA��2molB����ԭƽ��Ϊ��Чƽ�⣬ƽ��ʱ����ֵĺ������䣬��������ƽ����Է����������䣬D��ȷ����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ʳ�û����ͻ���ˮ�ݣ��㽫�������к��ַ������� �� ��
A. ���� B. ���� C. ��Һ D. ��ȡ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ȱ�������ͬ���칹�壬�����屽����ͬ���칹��
A.1��B.2��C.3��D.4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��ֻ���ܺ���K����NH4����Fe2����Al3����Cl����SO42����CO32����AlO2�� �е�����������������Ũ�Ⱦ�Ϊ0.1 mol��L��1��ijͬѧ����������ʵ�飬����˵����ȷ����
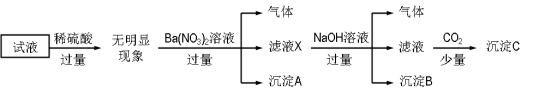
A����ȷ��ԭ��Һ���Ƿ���Al3����Cl��
B����ҺX�д������ڵ���������NH4����Fe2����Ba2��
C����ȷ������C�ijɷ�
D��ԭ��Һ�д��ڵ�����ΪNH4����Fe2����Cl����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2L���ܱ������У�X��Y��Z������������ʵ�����ʱ��仯����������ͼ��ʾ����������ȷ����

A. ��Ӧ��ʼ��10s����Z��ʾ�ķ�Ӧ����Ϊ0.158 mol/(Ls)
B. ��Ӧ��ʼ��10s��X�����ʵ���Ũ�ȼ�����0.79 mol/L
C. ��Ӧ��ʼ��10s��Y��ת����Ϊ79.0 %
D. ��Ӧ�Ļ�ѧ����ʽΪ��X��Y![]() Z
Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ�˵������ȷ����
A.��Ȼ������Ҫ�ɷ�����ϩ
B.��������Ҫ������ú������ú����
C.���͡�ú�͡�������Ҫ������ʯ�͵ij�ѹ����
D.��ϩ��ʯ���ѽ��IJ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�CO2�����öԴٽ���̼���Ĺ���������Ҫ���塣
�� ��CO2�뽹̿��������CO��CO�����������ȡ�
��֪��Fe2O3(s) + 3C(ʯī) = 2Fe(s) + 3CO(g) ��H 1 = +489.0 kJ��mol��1
C(ʯī) + CO2(g) =2CO(g) ��H 2 = +172.5 kJ��mol��1
��CO��ԭFe2O3(s)���Ȼ�ѧ����ʽΪ___________________________________________��
�� ������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) ��H
CH3OH(g) +H2O(g) ��H
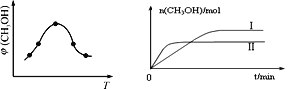
�� ȡһ�����CO2��H2�Ļ������(���ʵ���֮��Ϊ1��3)����������ܱ������У�����������Ӧ����Ӧ�����в�ü״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ��ͼ��ʾ����÷�Ӧ��H_______0(����>������<����������)��
�� �����ֲ�ͬ�����·�����Ӧ�����CH3OH�����ʵ�����ʱ��仯��ͼ��ʾ������I�����Ӧ��ƽ�ⳣ����С��ϵΪ��K��______K��(����>�� ����<��)��
�� ��CO2Ϊԭ�ϻ����Ժϳɶ������ʡ��ٹ�ҵ������[CO(NH2)2]��CO2��NH3��һ�������ºϳɣ��䷴Ӧ����ʽΪ_____________________________________������̼��n(NH3 )/n(CO2 )��3����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�ʮ�Ŵ�ָ�����ӿ�ˮ��Ⱦ���Ρ�ʵʩ�����ͽ��������ۺ�������������Ⱦ�������ǻ�ѧ�������о�����Ҫ���⣬Ҳ�Ǽ��С���ˮ��ɽ���ǽ�ɽ��ɽ������Ҫ�ٴ롣���ʵ��������£���CO2ת��Ϊ�״������ѵ��л���ȿɽ���CO2��ɵ�����ЧӦ�Ի�����Ӱ�죬���ɵõ���Ҫ���л����
(1)��֪����2H2(g)+O2(g)=2H2O(g) ��H1=484 kJ/mol
��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H2=50 kJ/mol
CH3OH(g)+H2O(g) ��H2=50 kJ/mol
��2CH3OH(g)+3O2(g)= 2CO2(g)+4H2O(g) ��H����H=_____________��
(2)��֪T Kʱ��ij�����ܱ������д������·�Ӧ��2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ��H<0����������в�ͬʱ��ʱ�����ʵ�Ũ��(mol/L)���±���ʾ��
CH3OCH3(g)+3H2O(g) ��H<0����������в�ͬʱ��ʱ�����ʵ�Ũ��(mol/L)���±���ʾ��
c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
��ʼʱ | a | b | 0 | 0 |
10 sʱ | 3 | 0.5 | c | 1.5 |
������Ӧ��ʼ��10sʱ����ڣ�v(H2)=_____________��������߷�Ӧ���ʣ��������H2ת���ʵķ�����________________________��
����T Kʱ����ѧƽ�ⳣ��K=15����10 s ʱv(��)_______v(��)���>����<����=��������ʱCO2��ת����Ϊ________��
(3)һ�������£���ij�����ܱ������г���x mol CO2��y mol H2�������ķ�ӦΪCO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H=50 kJ��mol1��
CH3OH(g)+H2O(g) ��H=50 kJ��mol1��
����ͼ1���ܱ�ʾ�÷�Ӧ��ƽ�ⳣ��K���¶�T֮��ı仯��ϵ����Ϊ______���a����b���������ж�������__________________________________��
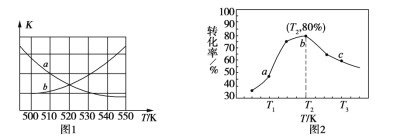
����x=2��y=3���������ͬʱ���ڲ�ͬ�¶���H2��ת������ͼ2��ʾ�����ڸ�ʱ����ڣ�ǡ�ôﵽ��ѧƽ��ʱ�������ڵ�ѹǿ�뷴Ӧ��ʼʱ��ѹǿ֮��Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ϳɰ���������ط�ӦΪ��N2(g)+3H2(g) ![]() 2NH3(g) ��H=��93kJ/mol
2NH3(g) ��H=��93kJ/mol
(1)�Ը��ݱ������м������ݼ���a����ֵΪ_____________��

(2)��600���£���2L�ܱ������г���һ�����ķ�Ӧ�ﲢ��ʼ������Ӧ��ͼ��ʾN2�����ʵ�����ʱ��ı仯���ߡ�
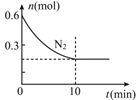
��H2��ʾ0~10min�ڸ÷�Ӧ��ƽ������v(H2)= _____________�������¶���K=0.0016L2/mol2������10minʱc(H2)= _____________��
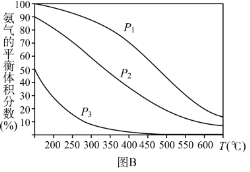
(3)�ڹ����ϳɷ��У�ƽ��ʱNH3����������뷴Ӧ��ϵ��ѹǿ(P)���¶�(T)�Ĺ�ϵ��ͼB����P1_____________P2(ѡ��������������С������������ȷ����)������������ͬ����ͬѹǿ���ڸտ�ʼ��Ӧʱ��Ӧ������Ũ�Ƚϴ����_____________(ѡ����P1������P2������P3����������ȷ����)�����ձ��ĺϳɰ���ҵ�У�ѡ��ϳ��¶�Ϊ700���Ľϸ��£��Դӻ�ѧ����ѧ�ĽǶȷ�����������_____________��
(4)�о��������ϳɰ���������������ʵ�Ũ�ȵĹ�ϵΪv=kc(N2)c(H2)3/2c(NH3)��1��kΪ���ʳ�������ʹ�ϳɰ�����������Ĵ�ʩ��_____________��
A.ʹ�ø���Ч�Ĵ���
B.��ѹǿһ��������n(N2 )/n(H2)��ֵ
C.���߷�Ӧ�¶�
D.����ԭ����ֵ����Ӧ���Ũ��
E.��ԭ������NH3��ʱ�������
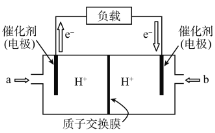
(5)��ͼ������NH3�������ͷų����ܵĵ�ؽṹʾ��ͼ(��������Ϊ����Ⱦ������)���ŵ�ʱO2Ӧ��_____________(����a������b��)��ͨ�룬�õ�ظ����ĵ缫��ӦʽΪ_____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com