
【题目】下列叙述正确的是![]()
A.可以根据![]() 和AgCl的Ksp的大小比较两者的溶解能力
和AgCl的Ksp的大小比较两者的溶解能力
B.常温下,同浓度的![]() 与NaHS溶液相比,NaHS溶液的pH大
与NaHS溶液相比,NaHS溶液的pH大
C.等物质的量浓度的![]() 溶液和
溶液和![]() 溶液,后者的
溶液,后者的![]() 大
大
D.能使碘化钾淀粉试纸变蓝的溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 等离子可以大量共存
等离子可以大量共存
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E为上述四种元素中的两种或三种所组成的化合物。已知A的相对分子质量为28,B分子中含有18个电子,五种化合物间的转化关系如图所示。下列说法错误的是( )
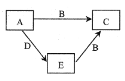
A. X、Y组成化合物的沸点一定比X、Z组成化合物的沸点低
B. Y的最高价氧化物的水化物为弱酸
C. Y、Z组成的分子可能为非极性分子
D. W是所在周期中原子半径最小的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.在![]() 、101KPa条件下,1mol液态水汽化为水蒸气吸收的热量为
、101KPa条件下,1mol液态水汽化为水蒸气吸收的热量为![]() ,则
,则![]() 的
的![]()
B.已知![]() 的
的![]() ,则所有含固体
,则所有含固体![]() 的溶液中,都有
的溶液中,都有![]() ,且
,且![]()
C.已知:![]() 的键能
的键能![]() ,
,![]() 的键能
的键能![]() ,
,![]() 的键能
的键能![]() ,
, ![]() 的键能
的键能![]() ,则反应
,则反应 (g)+3H2(g)→
(g)+3H2(g)→![]() (g)的焓变为:
(g)的焓变为:![]()
![]()
D.碳酸氢钠溶液中存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池如图所示,a、b均为惰性电极。下列叙述不正确的是
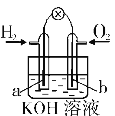
A.a极是负极,该电极上发生氧化反应
B.b极反应是O![]() +4OH
+4OH![]() -4e
-4e![]() =2H
=2H![]() O
O
C.总反应方程式为2H![]() +O
+O![]() =2H
=2H![]() O
O
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们利用原电池原理制作了多种电池,以满足日常生活、生产和科学技术等方面的需要。请根据题中提供的信息,回答下列问题。
(1)铅蓄电池在放电时的电池反应为Pb+PbO2+2H2SO4==2PbSO4+2H2O,则其正极上的电极反应为___________。
(2)FeCl3溶液腐蚀印刷电路铜板时发生反应:2FeCl3+Cu==2FeCl2+ CuCl2。若将此反应设计成原电池,则负极所用的电极材料为_____;电极反应式:_________。
(3)用Fe做阳极,KOH溶液做电解质溶液,进行电解,在阳极得到FeO![]() ,写出阳极的电极反应式____________________________________
,写出阳极的电极反应式____________________________________
(4)已知甲醇燃料电池的工作原理如下图所示。该电池工作时,b口通入的物质为_____,该电池正极上的电极反应式为 _______________;当6.4g甲醇(CH3OH)完全反应生成CO2时,有____mol电子发生转移。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述不正确的是 ( )
A. 2.0 g D2O中含有的质子数、电子数均为NA
B. 室温下,7 g乙烯和丁烯的混合气体中所含的氢原子数目是NA
C. 室温下,2 L 0.05 mol·L-1 NH4NO3溶液中所含的氮原子数目是0.2NA
D. 256 g S8(分子结构如图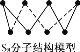 )含S—S键数目为7NA
)含S—S键数目为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是
A.0.1mol氧化钠固体中离子个数为0.2NA
B.1mol金刚石中含C-C键的数目为4NA
C.标准状况下,22.4L乙炔中含π键数为2NA
D.1mol NaHSO4晶体中阳离子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,△H1>△H2的是 ( )
①C(s)+O2(g)=CO2(g) △H1 、C(s)+![]() O2(g)=CO(g) △H2
O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H1 、S(g)+O2(g)=SO2(g) △H2
③H2(g)+![]() O2(g)=H2O(l) △H1 、2H2(g)+O2(g)=2H2O(l) △H2
O2(g)=H2O(l) △H1 、2H2(g)+O2(g)=2H2O(l) △H2
④CaCO3(s)=CaO(s)+CO2(g) △H1 、CaO(s)+H2O(l)=Ca(OH)2(s) △H2
A. ①B. ④C. ②③④D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
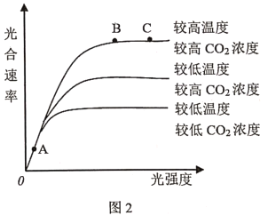
【题目】卡尔文循环过程如图1所示,探究各种环境因素对光合作用的综合影响结果如图2所示。请分析回答:
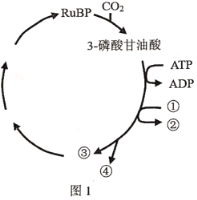
(1)图1过程在叶绿体的________中进行,RuBP的组成元素是________,![]() 和RuBP结合产生3-磷酸甘油酸的过程________(需要(不需要)消耗ATP。
和RuBP结合产生3-磷酸甘油酸的过程________(需要(不需要)消耗ATP。
(2)图1中的物质①可以为3-磷酸甘油酸的还原提供________,每生成1分子物质④需要经过________轮卡尔文循环,此时有________分子物质③用于RuBP的再生。
(3)图2中的自变量为________,限制A点光合速率的主要因素是________;若由A点条件变为B点条件,则短时间内3-磷酸甘油酸的生成速率________(增大/减小/基本不变);若由B点条件变为C点条件,则短时间内3-磷酸甘油酸的生成速率________(增大/减小基本不变)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com