
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C22﹣存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( ) 
A.1 个 Ca2+周围距离最近且等距离的 C22﹣数目为 6
B.该晶体中的阴离子与F2是等电子体
C.6.4 g CaC2晶体中含阴离子0.1 mol
D.与每个Ca2+距离相等且最近的Ca2+共有12个
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.回答有关问题:
(1)从能量的角度看,断开化学键要 , 形成化学键要
(2)已知拆开1molH﹣H键、1molI﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘反应生成1mol HI需要(填“放出”或“吸收”)kJ的热量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如图所示: 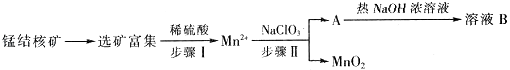
部分难溶的电解质溶度积常数(Ksp)如下表:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10﹣17 | 10﹣17 | 10﹣39 |
已知:一定条件下,MnO4﹣可与Mn2+反应生成MnO2
(1)步骤Ⅱ中消耗0.5molMn2+时,用去1molL﹣1的NaClO3溶液200ml,该反应离子方程式为 .
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是 .
(3)MnO2是碱性锌锰电池的正极材料.放电过程产生MnOOH,该电池正极的电极反应式是 . 如果维持电流强度为5A,电池工作五分钟,理论消耗锌g.(已知F=96500C/mol)
(4)向废旧锌锰电池内的混合物(主要成分MnOOH、Zn(OH)2)中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的离子方程式 . 向所得溶液中滴加高锰酸钾溶液产生黑色沉淀,设计实验证明黑色沉淀成分为MnO2
(5)用废电池的锌皮制作ZnSO47H2O的过程中,需除去锌皮中的少量杂质铁,其方法是:加入稀H2SO4和H2O2 , 铁溶解变为Fe3+ , 加碱调节pH为时,铁刚好沉淀完全(离子浓度小于1×10﹣5molL﹣1时,即可认为该离子沉淀完全).继续加碱调节pH为时,锌开始沉淀(假定Zn2+浓度为0.1molL﹣1).若上述过程不加H2O2 , 其后果和原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,当X,Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( ) 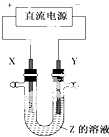
A.氯碱工业中,X,Y均为石墨,X附近能得到氢氧化钠
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C.电镀工业中,X是待镀金属,Y是镀层金属
D.外加电流的阴极保护法中,Y是待保护金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化. 
请回答下列问题:
(1)实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是热反应,Ba(OH)28H2O与NH4Cl的反应是热反应.反应过程(填“①”或“②”)的能量变化可用图2表示.
(2)下列变化属于放热反应的是 A.碳酸钙的分解反应 B.酸碱中和反应 C.碳和水蒸气的反应 D.浓硫酸稀释 E.实验室制取氨气 F.实验室制取氢气
(3)现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Cu═2FeCl2+CuCl2①以上两个反应能设计成原电池的是
②写出设计原电池正、负极电极反应式正极:负极: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)NO2可用水吸收,相应的化学反应方程式为 . 利用反应6NO2+8NH37N2+12H2O也可处理NO2 . 当消耗的NO2在标准状况下为67.2L转移电子数为 .
(2)已知:NO2(g)+SO2(g)SO3(g)+NO(g)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 . a.体系压强保持不变 b混合气体颜色保持不变
c.体系内密度保持不变 d.每消耗1mol SO3的同时消耗1mol NO2
e.体系内的平均摩尔质量保持不变.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B. 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C. 两原子,如果核外电子排布相同,则一定属于同种元素
D. 只有在原子中,质子数才与核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析正确的是( )
A.用湿润的pH试纸测稀碱液的pH,测定值偏大
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com