
【题目】下列图示与对应的叙述相符的是
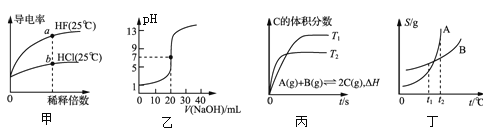
A. 由图甲可知,![]() 点Kw的数值比
点Kw的数值比![]() 点Kw的数值大
点Kw的数值大
B. 乙表示![]()
![]() 溶液滴定
溶液滴定![]()
![]() 醋酸溶液的滴定曲线
醋酸溶液的滴定曲线
C. 丙表示在相同的密闭容器中,不同温度下的反应,该反应的![]()
D. 丁表示![]() 、
、![]() 两物质的溶解度随温度变化情况,将
两物质的溶解度随温度变化情况,将![]() 时
时![]() 、
、![]() 的饱和溶液分别升温至
的饱和溶液分别升温至![]() 时,溶质的质量分数
时,溶质的质量分数![]()
【答案】C
【解析】
A. Kw只与温度有关;
B. 0.1000mol/L醋酸溶液中氢离子浓度小于0.1mol/L,醋酸钠溶液呈碱性;
C. 由图可以知道,T1<T2,结合温度对平衡的影响分析;
D. t1℃时A、B的饱和溶液中ω(A)=ω(B),升高温度,溶液的质量分数不变。
A.因为温度不变,而Kw只与温度有关,所以a点Kw的数值与b点Kw的数值相同,故A错误;
B.0.1000mol/L醋酸溶液中氢离子浓度小于0.1mol/L,所以滴定前醋酸溶液的pH大于1,且两者恰好完全反应时所得醋酸钠溶液呈碱性,图象不符,故B错误;
C. 由图可以知道,T1<T2,温度越高,C的含量越小,说明该反应为放热反应,即该反应的ΔH < 0, C正确;
D. t1℃时A、B的饱和溶液中ω(A)=ω(B),升高温度,溶液变为不饱和,没有溶质析出,所以溶液的质量分数不变,因此ω(A)=ω(B),D错误;
综上所述,本题选C。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_____与盐酸反应最剧烈,____与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明非金属性:Cl____S(填“>”或“<”),反应的离子方程式为_______。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律。

(3)仪器A的名称为___________,干燥管D的作用为___________________。
(4)若要证明非金属性:Cl>I,C中为淀粉—碘化钾混合溶液,B中装有KMnO4固体,则A中试剂为___________,观察到C中溶液____________(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_________溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液。观察到C中溶液 ________(填现象),即可证明。但有的同学认为盐酸具有挥发性,HCl可进入C中干扰实验,应在两装置间添加装有 _________溶液的洗气瓶除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A.22.4 L O3中一定含有3 mol O
B.常温常压下28 g N2和28 g CO中含有的原子个数相等
C.将10 g CaCO3投入水中再加水至100 mL,所得溶液中Ca2+物质的量浓度为1 mol/L
D.在标准状况下11.2 L H2O中含有1 mol H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡常数![]() 、电离常数(Ka、Kb)、溶度积常数
、电离常数(Ka、Kb)、溶度积常数![]() 等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
A. 当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)和溶度积常数![]() 一定均变大
一定均变大
B. ![]() 说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强
说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强
C. 向氯化钡溶液中加入等体积同浓度的碳酸钠和硫酸钠溶液,先产生![]() 沉淀,则
沉淀,则![]()
D. 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:__________与盐酸反应最剧烈,__________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_______,________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。

(3)仪器A的名称为________,干燥管D的作用是_____________________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_________________________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象及结论均正确的是
实验操作、现象 | 结论 | |
A | 取1 mL 20%的蔗糖溶液,加入3~5滴稀硫酸。水浴加热5 min后取少量溶液,加入少量新制Cu(OH)2,加热,无砖红色沉淀产生 | 蔗糖没有发生水解 |
B | 向装有溴水的分液漏斗中加入裂化汽油,充分振荡并静置,下层为橙色 | 裂化汽油可以萃取溴 |
C | 将SO2通入紫色石蕊溶液中,溶液先变红后褪色 | SO2是酸性氧化物,还具有漂白性 |
D | 分别向盛有KI3溶液的a、b试管中滴加淀粉溶液、AgNO3溶液,a中溶液变蓝,b中产生黄色沉淀 | 溶液中存在:I3- |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(![]() )广泛存在于食品中,人们对其及相关产品进行了深入研究。
)广泛存在于食品中,人们对其及相关产品进行了深入研究。
(1)已知![]() 时,
时,![]() :
:![]() ,
,![]() 溶液显酸性。解释
溶液显酸性。解释![]() 溶液显酸性的原因:______;(用化学用语并配以必要文字说明)
溶液显酸性的原因:______;(用化学用语并配以必要文字说明)
(2)已知反应:![]() ,为了使草酸分解,通过
,为了使草酸分解,通过![]() 燃烧反应提供能量:
燃烧反应提供能量:![]() ,已知分解的草酸与所需空气(其中氧气的体分数为
,已知分解的草酸与所需空气(其中氧气的体分数为![]() )的物质的量之比为
)的物质的量之比为![]() ,则
,则![]() ______
______
(3)草酸分解生成的![]() 燃料燃烧不足以提供足够的能量,还可通过甲烷来制备
燃料燃烧不足以提供足够的能量,还可通过甲烷来制备![]() 。在密闭容器中通入物质的量浓度均为
。在密闭容器中通入物质的量浓度均为![]() 的
的![]() 和
和![]() ;在一定条件下发生反应
;在一定条件下发生反应![]() ,测得
,测得![]() 的平衡转化率与温度、压强的关系如下图1所示。
的平衡转化率与温度、压强的关系如下图1所示。

①由图判断压强![]() 、
、![]() 、
、![]() 、
、![]() 由小到大的顺序为:______;该反应的
由小到大的顺序为:______;该反应的![]() ______0(填“<”“>”“=”):
______0(填“<”“>”“=”):
②![]() 该反应的平衡常数为______(结果保留两位小数)
该反应的平衡常数为______(结果保留两位小数)
(4)常温下,向![]() 的
的![]() 溶液中逐滴加入
溶液中逐滴加入![]()
![]() 溶液,所得滴定曲线如图所示。下列说法正确的是______
溶液,所得滴定曲线如图所示。下列说法正确的是______
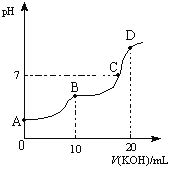
①![]() 点时:
点时:![]()
②![]() 点时:
点时:![]()
③![]() 点时:
点时:
④![]() 点时:
点时:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1
2H2O2(l)===2H2O(l)+O2(g) ΔH2
2H2(g)+O2(g)===2H2O(l) ΔH3
则反应Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l)的ΔH是
A. ΔH=ΔH1+1/2ΔH2+1/2ΔH3 B. ΔH=ΔH1+1/2ΔH2-1/2ΔH3
C. ΔH=ΔH1+2ΔH2+2ΔH3 D. ΔH=2ΔH1+ΔH2+ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g) ![]() Fe3O4 (s)+4H2(g) ,在一个可变容积的密闭容器中进行,试回答:
Fe3O4 (s)+4H2(g) ,在一个可变容积的密闭容器中进行,试回答:
(1)增加Fe的量,其正反应速率的变化是__________(填“增大”“不变”或“减小”,以下相同)。
(2)将容器的体积缩小一半,其正反应速率__________,逆反应速率__________。
(3)保持体积不变,充入N2 使体系压强增大,其正反应速率__________,逆反应速率__________。
(4)保持压强不变,充入N2使容器的体积增大,其正反应速率__________,逆反应速率__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com