
����Ŀ����������Ԫ�أ�����A��B��C��D��EΪԭ����������������ԭ��������������36����������������Ϣ���ش����⣮
A | ��̬ԭ�������������Ǵ��������� |
B | ��̬ԭ�Ӻ�����13�ֲ�ͬ�˶�״̬�ĵ��� |
C | ��Bͬһ���ڣ�ԭ����δ�ɶԵ�������ͬ��������� |
D | D2-�ĺ�������Ų����ԭ����ͬ |
E | ��ds��ԭ��������С��Ԫ�� |
��1�����B�Լ�Bͬ������ԭ��������BС��ԭ�Ӱ���һ�����ܴӴ�С��˳�����У�____________(����Ӧ��Ԫ�ط��ű�ʾ)��A��D����Ԫ���У��縺��A____________D (����������������)
��2��A3���ӵĿռ乹��Ϊ____________�����以Ϊ�ȵ�����ķ���Ϊ____________��
��3��������ˮ�е��ܽ��C7H15OH���Ҵ��͵�ԭ���ǣ�____________��C7H15OH �в���sp3�ӻ���ԭ�ӹ���____________����
��4��E(NH3)42+�������д��ڵĻ�ѧ��������____________(�����):
����λ�� �������� �����Թ��ۼ� ���Ǽ��Թ��ۼ� �����Ӽ� �����
�� E(NH3)42+���жԳƵĿռ乹�ͣ��ҵ� E(NH3)42+�е�����NH3���ӱ�����Clһȡ��ʱ���ܵõ����ֲ�ͬ�ṹ�IJ���� E(NH3)42+�Ŀռ乹��Ϊ____________(�����)��
a��ƽ��������b���������� c�������� d��V��
��5������E������ͼ��ʾ����֪EԪ�����ԭ������ΪM��ԭ�Ӱ뾶Ϊr pm���ܶ�Ϊ��g/cm3(1pm=10-10cm)��ôд������٤������NA�ı���ʽ____________(��M��r������ʾ)��
���𰸡���1��Mg��Al��Na������
��2��V��SO2��
��3���Ҵ��е��ǻ���ˮ���ǻ��ṹ���������ܽ�ȴ�C7H15OH����������ˮ���ǻ��ṹ���Ƴ̶�С�����ܽ��С��8��
��4���٢���a��
��5��![]()
�����������������A��̬ԭ�������������Ǵ���������������������������8��ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����AΪOԪ�أ�B��̬ԭ�Ӻ�����13�ֲ�ͬ�˶�״̬�ĵ��ӣ���BΪAlԪ�أ�C��Bͬһ���ڣ�ԭ����δ�ɶԵ�������ͬ���������ģ���CΪPԪ�أ� D2-�ĺ�������Ų����ԭ����ͬ����DΪSԪ�أ�E��ds��ԭ��������С��Ԫ�أ���EΪCuԪ�ء�
��1��BΪAl��ͬ����ԭ��������AlС����Na��Mg��ͬ����Ԫ�ص�һ�����ܴ����ҳ��������ƣ���Mgԭ��3s���Ϊȫ���ȶ�״̬�����һ�����ܴ���Al�ģ����Ե�һ������Mg��Al��Na��ͬ�������϶��µ縺�Լ�С�����Ե縺��O��S���ʴ�Ϊ��Mg��Al��Na������
��2��O3��������ԭ�ӹµ��Ӷ���=![]() ��(62��2)=1���۲���Ӷ���=2+1=3�����ӹ���ΪV�Σ�O3����ԭ����Ϊ3���۵�����Ϊ18������ȵ�����ΪSO2���ʴ�Ϊ��V�Σ�SO2��
��(62��2)=1���۲���Ӷ���=2+1=3�����ӹ���ΪV�Σ�O3����ԭ����Ϊ3���۵�����Ϊ18������ȵ�����ΪSO2���ʴ�Ϊ��V�Σ�SO2��
��3���Ҵ��е��ǻ���ˮ���ǻ��ṹ���������ܽ�ȴ�C7H15OH����������ˮ���ǻ��ṹ���Ƴ̶�С�����ܽ��С��C7H15OH������Cԭ�ӡ�Oԭ�ӵļ۲���ӶԾ�Ϊ4�����Բ���sp3�ӻ���ԭ����8��ԭ�ӣ��ʴ�Ϊ���Ҵ��е��ǻ���ˮ���ǻ��ṹ���������ܽ�ȴ�C7H15OH����������ˮ���ǻ��ṹ���Ƴ̶�С�����ܽ��С��8��
��4��[Cu(NH3)4]2+��Cu2+��NH3֮��Ļ�ѧ��Ϊ��λ����N-HΪ���Թ��ۼ����� Cu(NH3)42+���жԳƵĿռ乹�ͣ��ҵ� Cu(NH3)42+�е�����NH3���ӱ�����Clȡ��ʱ���ܵõ����ֲ�ͬ�ṹ�IJ���� Cu(NH3)42+�ռ乹��Ϊƽ�������Σ��ʴ�Ϊ���٢���a��
��5������Cu������ԭ����Ϊ8��![]() +6��
+6��![]() =4����������Ϊ4��
=4����������Ϊ4��![]() g��ԭ�Ӱ뾶Ϊr pm�����ⳤd=
g��ԭ�Ӱ뾶Ϊr pm�����ⳤd=![]() ��4r=2
��4r=2![]() r��10-10cm����4��
r��10-10cm����4��![]() g=(2
g=(2![]() r��10-10cm)3����g/cm3����NA=
r��10-10cm)3����g/cm3����NA=![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������о���������ԭ�Ϻϳɸ߷��Ӳ���PET���������£�
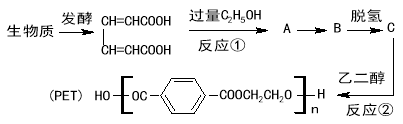
��֪����������Ӧ��
![]()
![]()
��ش��������⣺
��1����Ӧ������ ��Ӧ��
��2��PET������������ ��
��3���л���A��B�Ľṹ��ʽ�ֱ��� �� ��
��4��д����Ӧ�ڵĻ�ѧ����ʽ ��
��5�����л���A��ͬ���칹��F��Һ�еμ��Ȼ�����Һ����ɫ��F�ı��������ĸ�ȡ������һ�ȴ�����ֻ��һ�֣�0.1molF �������Ľ����Ʒ�Ӧ������0.15mol������F�ĺ˴Ź���������4�����շ塣��д��������������F�Ľṹ��ʽ ����дһ�֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڹ�ҵ���й㷺��;����ش��������⣺
��1����ҵ������N2(g)+3H2(g) ![]() 2NH3(g) H<0�ϳɰ���ijС��Ϊ��̽����������Ը÷�Ӧ��Ӱ�죬��c0 mol/L H2�μӺϳɰ���Ӧ����a��b���������·ֱ�ﵽƽ�⣬��ͼA��
2NH3(g) H<0�ϳɰ���ijС��Ϊ��̽����������Ը÷�Ӧ��Ӱ�죬��c0 mol/L H2�μӺϳɰ���Ӧ����a��b���������·ֱ�ﵽƽ�⣬��ͼA��
�����a���ԣ�b���ܸı�������� ���жϵ�������__________________��
��a�����£�0��t0��ƽ����Ӧ����v(N2)= mol��L-1��min-1�� 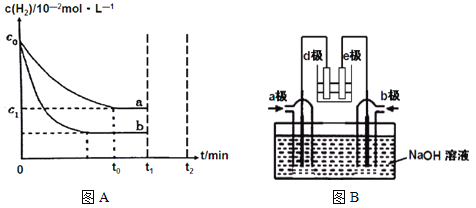
��2����������NH3��NO2���ɵ�صķ���������ʵ����Ч��������������ŷż��ٻ�����Ⱦ�����ܳ�����û�ѧ�ܽ��д����ľ�������ͼB��ʾ��e��Ϊ������
a��ͨ�� ����(�ѧʽ)���жϵ�������___________________________________
��3��ijС����һ���º�ѹ��������9mol N2��23mol H2ģ��ϳɰ���Ӧ��ͼCΪ��ͬ�¶���ƽ�������а����������������ѹǿ��p���Ĺ�ϵͼ������ϵ��T2��60MPa�´ﵽƽ�⡣
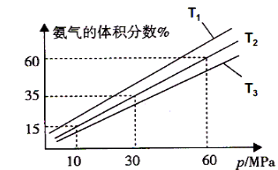
ͼC
�����ж�N2(g)+3H2(g)![]() 2NH3(g)�ﵽƽ�����______(�����)��
2NH3(g)�ﵽƽ�����______(�����)��
a��������ѹǿ���ٷ����仯 b�����������ܶȲ��ٷ����仯
c��v��(N2)=3v��(H2) d����������ƽ����Է����������ٷ����仯
����T1��T2��T3�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2��K3����K1��K2��K3�ɴ�С������Ϊ ��
�۴�ʱN2��ƽ���ѹΪ MPa������ѹ����ѹ�����ʵ���������
�������ʱ��ƽ�ⳣ��Kp= ������ƽ���ѹ����ƽ��Ũ�ȼ��㣬�������2λ��Ч���ֲ����ϵ�λ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ���ͣ���Ҫ�Ǻ�17��̼ԭ�����ϵ�Һ̬���������ֽ�ʵ�鰴����ͼ���У�
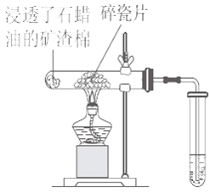
��1��ʯ���ͷֽ�ʵ��������������Ҫ�ɷ��� ����д��ţ���
��ֻ�м��� ��ֻ����ϩ ��������ϩ���Ļ���
��2����ʯ���ͷֽ�����������ͨ�뵽���Ը��������Һ�У������� ��
��3�����Ƭ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��Dz��ֶ�����Ԫ�ص���Ϣ���û�ѧ����ش��������⡣
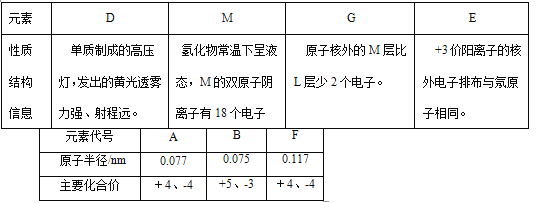
��1��Ԫ��A�����ڱ��е�λ�� ��B��ij�ֺ���������������������1�����ʾ�ú��ص�ԭ�ӷ���Ϊ ��
��2��д������Mԭ�Ӹ�����Ϊ1:2������ĵ���ʽ ����Aԭ�Ӹ�����Ϊ1:2�����ﺬ�еĻ�ѧ�����ͣ������Ӽ������ۼ���Ǽ��Լ��� ��
��3��M2-��D+��G2-���Ӱ뾶��С˳���� > > �������ӷ��Żش𣩡�
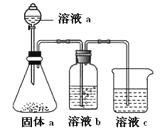
��4����A��B��M��������ԭ�ӹ��ɵķ���A2H5BM2���ȿ��Ժ����ᷴӦ�ֿ��Ժ�����������Һ��Ӧ��д��A2H5BC2������ ��
��5��ijͬѧ���ʵ��֤��A��B��F�ķǽ�����ǿ����ϵ��
�� ��Һa��b�ֱ�Ϊ �� ��
�� ��Һc�е����ӷ���ʽΪ ��
��6����0.5 mol D2M2Ͷ��100 mL 3 mol/L ECl3��Һ�У�ת�Ƶ��ӵ����ʵ���Ϊ ��
��7����ҵ��ұ��E����ʯīΪ�缫�����������Ļ������ijɷ�Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��2SO2(g)��O2(g)![]() 2SO3(g) ��H<0��ij�¶��£���2 mol SO2��1 mol O2����10 L�ܱ������У���Ӧ�ﵽƽ���SO2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ����ʾ��������˵����ȷ����( )
2SO3(g) ��H<0��ij�¶��£���2 mol SO2��1 mol O2����10 L�ܱ������У���Ӧ�ﵽƽ���SO2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ����ʾ��������˵����ȷ����( )

A. ��ͼ��֪��A��SO2��ƽ��Ũ��Ϊ0.4 mol��L��1
B. ��ͼ��֪��B��SO2��O2��SO3��ƽ��Ũ��֮��Ϊ2��1��2
C. ��ƽ�����С�����ݻ�����Ӧ���ʱ仯ͼ�������ͼ�ұ�ʾ
D. ѹǿΪ0.50 MPaʱ����ͬ�¶���SO2ת�������¶ȹ�ϵ���ͼ����T2>T1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������糧�ͷų���������������(NOx)��SO2�� CO2���������ɻ��������ȼú���������������������̼�ȴ�������ʵ����ɫ���������ܼ��š��������õ�Ŀ�ġ�
��1�����������ü������ԭNOx��
CH4(g)��4NO2(g)��4NO(g)��CO2(g)��2H2O(g) ��H1����574 kJ/mol
CH4(g)�� 4NO(g)��2N2(g)��CO2(g)��2H2O(g) ��H2����1160kJ/mol
����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ____________________��
��2����̼���� CO2ת��Ϊ�״���CO2 (g)��3H2 (g) ![]() CH3OH(g)��H2O(g) ��H3
CH3OH(g)��H2O(g) ��H3
����ͼ 1��25��ʱ�Լ״�ȼ�ϵ��(�������ҺΪ KOH)Ϊ��Դ�������(100mL2mol/LAgNO3��Һ)�ͱ�(100mLCuSO4)��Һ��ȼ�ϵ�ظ����ĵ缫��ӦΪ_______________��������������м��� 0.1mol Cu(OH)2��ǡ�ûָ�����Ӧǰ��Ũ�ȣ���������Һ��ˮϡ����200mL����Һ�� pH ______________��
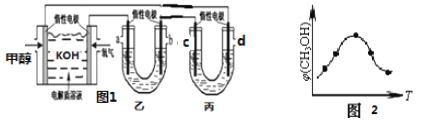
��ȡ��ݵ������ CO2��H2�Ļ������(���ʵ���֮�Ⱦ�Ϊ 1��3)���ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״���������� �� (CH3OH)�뷴Ӧ�¶� T �Ĺ�ϵ������ͼ 2 ��ʾ�������� CO2ת��Ϊ�״��ķ�Ӧ����H________3.0 (�����������������)��
��3������ȼú��������������̼����һ����������������Ӧ��������李�����ʱ����(NH4)2SO4����Һ�е��� NaOH ��Һ����Һ�����ԣ���������Һ����Ũ�ȴ�С��ϵc(Na��)________ c(NH3 H2O)��(�����������������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���밴Ҫ��ش��������⣺
��1��1-��ϩ����ˮ�ķ�Ӧ ��
��2����Է�������Ϊ72��ij������һ�ȴ���ֻ��һ�֣��������һ�ȴ���Ľṹ��ʽΪ_________��
��3����ϵͳ�����������������л�������
(CH3)2CHCH(CH3)2_____________________________��
 ______________________________��
______________________________��
��4����֪�ṹʽΪ �����ʻ�Ϊͬ���칹�������dz�֮Ϊ˳���칹��������ʽΪC5H10���л������ϩ����ͬ���칹�����ĿΪ_________�֣�����˳���칹����
�����ʻ�Ϊͬ���칹�������dz�֮Ϊ˳���칹��������ʽΪC5H10���л������ϩ����ͬ���칹�����ĿΪ_________�֣�����˳���칹����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�ȼ�Ϸ�Ϊ�״����ͺͼ״����ͣ���ҵ�ϳɼ״��ķ����ܶࡣ
��1��һ�������·�����Ӧ��
CO2��g��+3H2��g���TCH3OH��g��+H2O��g����H1
2CO��g��+O2��g���T2CO2��g����H2
2H2��g��+O2��g���T2H2O��g����H3
��CO��g��+2H2��g��CH3OH��g���ġ�H�T _________��
��2�����ݻ�Ϊ2L���ܱ������н��з�Ӧ��CO��g��+2H2��g��CH3OH��g���������������䣬��300���500��ʱ�����ʵ���n��CH3OH���뷴Ӧʱ��t�ı仯������ͼ1��ʾ���÷�Ӧ�ġ�H____0 ���������=����
��3����Ҫ��״��IJ��ʣ��ɲ�ȡ�Ĵ�ʩ�У�����ĸ��___________
A�����������
B�������¶�
C�������¶�
D��ʹ�ú��ʵĴ���
E�����״��ӻ����ϵ�з������

��4��CH4��H2O�ڴ������淢����ӦCH4+H2OCO+3H2��T��ʱ����1L�ܱ�������Ͷ��1mol CH4��1mol H2O��g����5Сʱ���÷�Ӧ��ϵ�ﵽƽ��״̬����ʱCH4��ת����Ϊ50%��������¶���������Ӧ�Ļ�ѧƽ�ⳣ��_____________________���������С�������λ���֣�
��5���Լ״�Ϊȼ�ϵ����͵�أ���ɱ�����������Ϊȼ�ϵĴ�ͳȼ�ϵ�أ�Ŀǰ�õ��㷺���о���ͼ2��Ŀǰ�о��϶��һ�����������ȼ�ϵ�ع���ԭ��ʾ��ͼ��B���ĵ缫��ӦʽΪ_________
��6��25��ʱ������Ƶ�Ksp=4.0��10��8��̼��Ƶ�Ksp=2.5��10��9����10ml̼��Ƶı�����Һ����μ���8.0��10��4molL��1�IJ������Һ10ml���ܷ��������__________����ܡ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com