
【题目】最近研究用生物质原料合成高分子材料PET的流程如下:
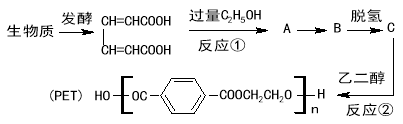
已知下列两个反应:
![]()
![]()
请回答下列问题:
(1)反应①属于 反应。
(2)PET的中文名称是 。
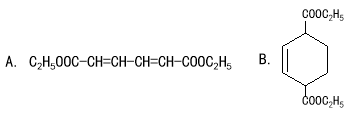
(3)有机物A、B的结构简式分别是 、 。
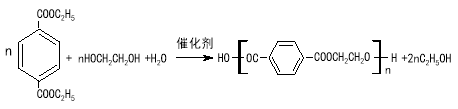
(4)写出反应②的化学方程式 。
(5)在有机物A的同分异构体F溶液中滴加氯化铁溶液显紫色。F的苯环上有四个取代基且一氯代物有只有一种,0.1molF 跟足量的金属钠反应,生成0.15mol氢气,F的核磁共振氢谱有4个吸收峰。试写出满足上述条件F的结构简式 (任写一种)。
【答案】(1)酯化(取代);(2)聚对苯二甲酸乙二酯;
(3)
(4)
(5)
【解析】
试题分析:根据题给转化关系知HOOCCH=CH﹣CH=CHCOOH与过量的乙醇发生酯化反应得到A,A为CH3CH2OOCCH=CH﹣CH=CHCOOCH2CH3,由PET的结构中含有苯环,则A发生信息(1)中的反应得到B,即与乙烯反应生成B为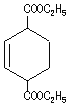 ,B脱氢得到C为
,B脱氢得到C为 ,C与乙二醇发生信息(2)中酯交换反应得到PET,据此作答。
,C与乙二醇发生信息(2)中酯交换反应得到PET,据此作答。
(1)反应①属于酯化反应或取代反应。
(2)PET的中文名称是:聚对苯二甲酸乙二酯。
(3)有机物A、B的结构简式分别是CH3CH2OOCCH=CH﹣CH=CHCOOCH2CH3、 。
。
(4)反应②的化学方程式: 。
。
(5)在有机物A的同分异构体F溶液中滴加氯化铁溶液显紫色,说明F含有酚羟基,F的苯环上有四个取代基且一氯代物只有一种,0.1molF跟足量的金属钠反应,生成0.15mol氢气,说明含有3个酚羟基,F的核磁共振氢谱有4个吸收峰,满足上述条件F的结构简式为: 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素原子的最外层电子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子。请回答下列问题:
(1)当n=2时,AB2属于__________分子(填“极性”或“非极性”),分子中有__________个δ键、__________个π键。A6H6分子中A原子的杂化轨道类型是__________杂化。
(2)当n=3时,A与B形成的晶体属于__________晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是__________(用元素符号表示).
(4)已知某红紫色配合物的组成为CoCl3·5NH3·H2O,该配合物中的中心离子钴离子在基态时的核外电子排布式为____________________。
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为__________。
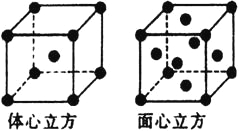
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生沼气,可用来点火做饭。在农村推广建造沼气池,不仅能有效地利用
能,还能为农业生产提供优良的肥料。已知: 标准状况下的112.0L CH4气体完全燃烧,生成CO2和液态水,放出4448kJ的热量。
①写出CH4完全燃烧的热化学方程式为 。
②如果上述反应生成的是水蒸气,则反应放出的热量 4448kJ。(填“>”或“<”或“=”)
(2)已知拆开1 mol H-H键、1 molN≡N、1 mol N-H键分别需要吸收的能量为436 .4kJ、941.3 kJ、390.5 kJ。则由1 mol NH3 分解生成氢气和氮气需要 (填“放出”或“吸收”) kJ的热量。
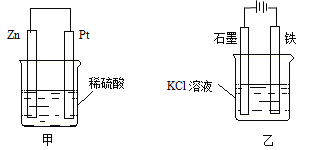
(3)在生产和生活中经常遇到化学能与电能的相互转化。在下列甲、乙两装置中,甲中负极电极反应式为 ;乙中铁电极的电极反应式为 ,铁电极发生 反应(填“氧化”或“还原”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如右图:
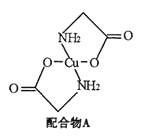
(1)Cu元素基态原子的外围电子排布图为 。
(2)配合物A中碳原子的轨道杂化类型为 。
(3)1mol氨基乙酸钠(H2N-CH2-COONa)含有![]() 键的数目为 。
键的数目为 。
(4)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体且为负一价阴离子: (写化学式)。
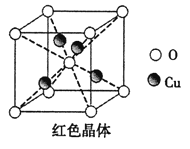
(5)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,则该化合物的化学式是 。
(6)配合物A中元素C、H、N、O组成CH4和NO在400~500℃和Pt做催化剂下转化成无毒害物质,利用该反应可以控制机动车尾气排放。该反应方程式为
___________ ________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用食盐和石灰石为主要原料,经不同的方法生成纯碱。请回答下列问题:
(1)卢布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取、结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为: __________________________________;
②硫酸钠和焦炭、石灰石反应的化学方程式为:__________________________ (已知硫酸钠做氧化剂,生成物中气体只有一种)。
(2)氨碱法的工艺如右图所示,得到的碳酸氢钠经煅烧生成纯碱。
①图中的中间产物C是___________,(填化学式,下同)D是___________;
②装置乙中发生反应的化学方程式为___________________;
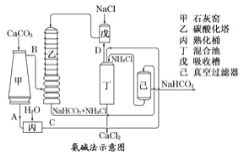
(3)联合制碱法是对氨碱法的改进,其优点是除了副产物氯化铵可用作化肥外还有_______________。
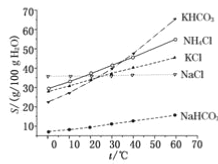
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石等为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年,雾霾阴影笼罩全国。二氧化硫、氮氧化物和可吸入颗粒物是雾霾的主要组成成分,综合治理其污染是环境化学当前的重要研究内容。
(1)汽车尾气中的 NO(g)和CO(g)在一定温度和催化剂的条件下可净化。发生的反应如下:2NO(g)+2CO(g)![]() 2CO2 (g)+N2 (g)
2CO2 (g)+N2 (g)
①已知:N2(g)+O2 (g)=2NO(g) ΔH=+180.0 kJ/mol。部分化学键的键能如下(键能指气态原子形成1mol化学键释放的最小能量)
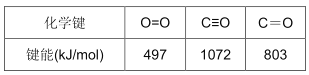
则反应:2NO(g)+2CO(g)![]() 2CO2 (g)+N2 (g) ΔH=__________ kJ/mol
2CO2 (g)+N2 (g) ΔH=__________ kJ/mol
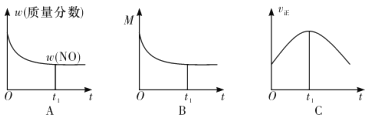
②若上述反应在绝热、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图不符合题意的是__________(填选项序号)。(图中 ω、M、v 正 分别表示质量分数、混合气体平均相对分子质量、正反应速率)
(2)尾气中的SO2可先催化氧化生成SO3,再合成硫酸。已知:2SO2(g)+O2 (g)![]() 2SO3(g) ΔH=-196.0 kJ/mol。
2SO3(g) ΔH=-196.0 kJ/mol。
①在一定温度的密闭容器中,SO2的转化率随时间的变化关系如图所示:
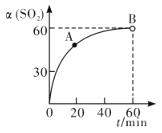
则A点的v逆(SO2 )__________(填―大于‖、―小于‖或―等于‖)B 点的 v正(SO2)。
②在某温度时,向10L的密闭容器中加入4.0 molSO2和10.0 molO2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平衡浓度和原来平衡浓度相同的是______(填选项序号)。
A.在其他条件不变时,减小容器的容积
B.保持温度和容器内压强不变,再充入2.0 mol SO2和5.0 mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍
(3)利用电化学原理,将NO2、O2和熔融KNO3 制成燃料电池,其原理如下图所示。
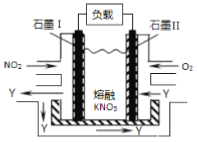
该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用。石墨Ⅱ是电池的____极,石墨Ⅰ附近发生的电极反应式为________________________。相同条件下,消耗的O2和NO2的体积比为_____。
(4)尾气中氮氧化物(NO和NO2 )也可用尿素[CO(NH2)2 ]溶液除去,反应生成对大气无污染的气体。1 mol 尿素能吸收工业尾气中氮氧化物(假设 NO、NO2体积比为 1∶1)的质量为___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ka 为平衡常数,pKa=﹣lgKa,25℃时,H2A的 pKa1 =1.85,pKa2=7.19。用 0.1mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2A溶液的滴定曲线如下图所示(曲线上的数字为 pH)。下列说法不正确的是

A.a 点所得溶液中;2c(H2A)+c(A2-)=0.002mol
B.b 点所得溶液中:c(H2 A)+c(H+)=c(A2-)+C(OH-)
C.C 点所得溶液中:c(Na+)<3c(HA-)
D.d 点所得溶液中:c(Na+)>c(A2-)>c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】乙酰苯胺具有解热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称,其制备原理如下:
已知:![]()
①苯胺易被氧化。
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
乙酰苯胺 | 114.3 | 305 | 微溶于冷水,易溶于热水 |
苯胺 | -6 | 184.4 | 微溶于水 |
醋酸 | 16.6 | 118 | 易溶于水 |
实验步骤如下:
步骤1:在a中,加入9mL (0.10 mol)苯胺、15 mL(0.27 mol)冰醋酸及少许锌粉,依照上图装置组装仪器。
步骤2:控制温度计读数在105℃左右,小火加热回流至反应完全。
步骤3:趁热将反应混合物倒入盛有100 mL 冷水的烧杯中,冷却后抽滤、洗涤,得到粗产品。
步骤4:将步骤3所得粗产品进一步提纯后,称得产品质量为10.8g。
请回答下列问题:
(1)仪器a的名称为 ,所选仪器a的最佳规格是 (填序号)。
A. 25 mL B.50 mL C.100 mL D.250 mL
(2)实验中加入少许锌粉的目的是 。
(3)步骤2中,控制温度计读数在105℃左右的原因是 。
(4)判断反应已基本完全的方法为 。
(5)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是 。
(6)步骤4中粗产品进一步提纯,该提纯方法是 。
(7)本次实验的产率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
A | 基态原子最外层电子数是次外层的三倍 |
B | 基态原子核外有13种不同运动状态的电子 |
C | 与B同一周期,原子中未成对电子数是同周期中最多 |
D | D2-的核外电子排布与氩原子相同 |
E | 是ds区原子序数最小的元素 |
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:____________(用相应的元素符号表示).A、D两种元素中,电负性A____________D (填“>”或“<”)
(2)A3分子的空间构型为____________,与其互为等电子体的分子为____________;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:____________,C7H15OH 中采用sp3杂化的原子共有____________个;
(4)E(NH3)42+配离子中存在的化学键类型有____________(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl一取代时。能得到两种不同结构的产物,则 E(NH3)42+的空间构型为____________(填序号)。
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3(1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式____________(用M、r、ρ表示)。
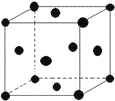
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com