
【题目】已知分解1mol KClO3放出热量38.8kJ,在MnO2下加热,KClO3的分解机理为:
①2KClO3+4MnO2![]() 2KCl+2Mn2O7 慢
2KCl+2Mn2O7 慢
②2Mn2O7![]() 4MnO2+3O2 快
4MnO2+3O2 快
下列有关说法不正确的是( )
A.1 mol KClO3所具有的总能量高于1 mol KCl所具有的总能量
B.KClO3分解速率快慢主要取决于反应①
C.1 g KClO3 ,1 g MnO2,0.1 g Mn2O7混合加热,充分反应后MnO2质量为1 g
D.将固体二氧化锰碾碎,可加快KClO3的分解速率
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】下列图象分别表示有关反应的反应过程与能量变化的关系,下列说法中正确的是
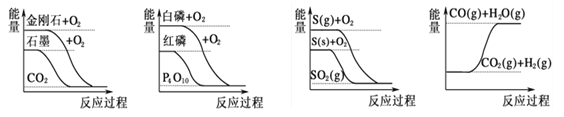
A. 石墨转变为金刚石是吸热反应
B. 相同条件下等质量S(g)比S(s)的能量低
C. 白磷比红磷稳定
D. CO(g)+H2O(g)═CO2(g)+H2(g)是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分类或归类正确的是:
①铝热剂、纯净矿泉水、冰水混合物均为混合物 ②NaOH、HD、IBr均为化合物
③明矾、烧碱、硫酸均为强电解质 ④C60、金刚石、石墨均为碳的同素异形体
⑤碘酒、淀粉溶液、水雾、纳米材料均为胶体
A. ①②③⑤ B. ③④⑤ C. ②④⑤ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填写下列问题:
(1)某些共价化合物(如H2O、NH3、N2O4等)在液态时会发生微弱的电离,如:2H2O ![]() H3O+ + OH—,则液态NH3电离的方程式是
H3O+ + OH—,则液态NH3电离的方程式是
(2)某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=10,则该温度下水的KW= ,在此温度下,将pH=b的NaOH溶液Vb L与pH=a的H2SO4溶液Va L混合,若所得混合液为中性,且a+b=13,则Va:Vb=
(3)25℃时,0.1mol/L的HA溶液中![]() =1010.请回答下列问题:
=1010.请回答下列问题:
①HA是 (填“强电解质”或“弱电解质”).
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是 (填字母)
A.c(HA) B.![]() C.c(H+)与c(OH-)的乘积 D.c(OH-)
C.c(H+)与c(OH-)的乘积 D.c(OH-)
(4)在常温下,中和相同体积,相同pH的Ba(OH)2、NH3H2O、NaOH三种稀溶液所用相同浓度的盐酸的体积分别为V1、V2、V3,则三种关系为 (用“V1、V2、V3”和“>、<、=”表示).
(5)今有A盐酸、B醋酸、C硫酸 三种酸:
①在同体积、同浓度的三种酸中,分别加入足量的碳酸氢钠粉末,在相同条件下产生CO2的体积由大到小的顺序是 .(填写酸的序号并用符号“>、<、=”连接,下同)
②在同体积、同pH的三种酸中,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的氢气(同温同压下),则开始反应时速率大小关系是 ,反应所用时间长短关系是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种短周期元素的位置如图所示(其中乙、丙、丁的位置未标出)。

已知四种元素的原子序数之和为36,乙的原子序数与甲、丁原子序数之和相等。
(1)甲元素在周期表中的位置为______________。
(2)丙、丁可形成AB2型化合物,其结构式为________。
(3)丙是自然界中形成化合物种类最多的元素,其单质与甲元素的最高价氧化物对应水化物的浓溶液共热时反应的化学方程式是______________________。
(4)若甲、乙、丙、丁四种元素两两化合时,丁与其他三种元素得到的化合物种类最多,写出这些化合物中任意两种符合以下条件的化学式_______________,________________________。(①原子个数比为1∶2;②分子中价电子总数为偶数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.锰是在地壳中广泛分布的元素之一,其单质和化合物在工农业生产中有着重要的作用。已知Al的燃烧热为ΔH=—ckJ·mol—1,金属锰可用铝热法制得。其余相关热化学方程式为:3Mn3O4(s)+8Al(s)=9Mn(s)+4Al2O3(s) ΔH1 = akJ·mol—1
3MnO2(s)=Mn3O4(s)+O2(g) ΔH2 = b kJ·mol—1
则3MnO2(s)+4Al(s)=3Mn(s)+2Al2O3(s) ΔH3 =__________kJ·mol—1(用含a、b、c的式子表示)
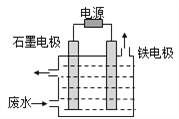
II.无机和有机氰化物在工农业生产中应用广泛,尤其是冶金工业常用氰化物,含氰废水的处理显得尤为重要。含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。
(1)电解处理法:用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为__________(填“阴极”或“阳极”),阳极产生ClO-的电极反应为__________,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为__________。
(2)UV(紫外光线的简称)—H2O2氧化法。
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,光照一定时间后取样分析。
【查阅资料】
①在强碱性溶液中4[Fe(CN)6]3-+4OH—=4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;
②[Fe(CN)6]3-转化为CN-容易被H2O2除去;
③HCN是有毒的弱酸,易挥发。
①废水中的CN一经以下反应实现转化:CN—+H2O2+H2O=A+NH3↑,则A是__________(用符号表示)。
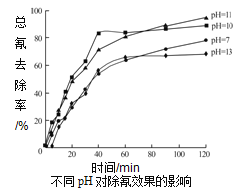
②含氰废水在不同pH下的除氰效果如图所示,pH选择的最佳范围应为__________(a.7-10;b.10-11;c.11-13),解释该pH不宜太大的原因__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:
CO(g)+Cl2(g)![]() COCl2(g)
COCl2(g)
其中容器Ⅰ中5 min时到达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应的正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ中加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO的转化率大于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)对于反应:2SO2(g)+O2(g) ![]() 2SO3(g);如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=________________________;υ(SO3)=_______________________。
2SO3(g);如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=________________________;υ(SO3)=_______________________。
(2)已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) ![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) ![]() SO3(g)+NO(g)的ΔH=______ kJ·mol-1。
SO3(g)+NO(g)的ΔH=______ kJ·mol-1。
(3)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。
a、体系压强保持不变 b、混合气体颜色保持不变
c、SO3和NO的体积比保持不变 d、每消耗1 mol SO3的同时生成1 mol NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com