
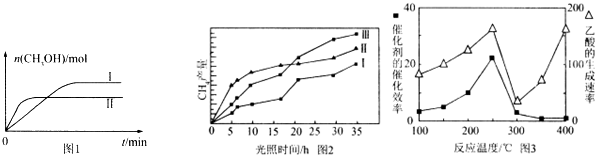
 CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1.
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1.| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c mol H2O(g) |
分析 (1)根据盖斯定律,由已知热化学方乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数并进行相应的加减,据此计算;
(2)CO燃料电池中,负极上是CO发生失电子的氧化反应,正极上是氧气发生得电子的还原反应,又因为电解质是KOH溶液,不会在电极上放出二氧化碳.
(3)①Ⅱ比Ⅰ的甲醇的物质的量少,根据K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(CO)•{c}^{3}({H}_{2})}$判断;
②根据平衡三部曲求出甲中平衡时各气体的物质的量,然后根据平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行来判断范围.
(4)相同时间甲烷的物质的量的变化量越大,表明平均速率越大,相同时间甲烷的物质的量的变化量越小,平均反应速率越小.由图2可知反应开始后的15小时内,在第Ⅱ种催化剂的作用下,收集的CH4最多,Ⅲ次之,Ⅰ最少.
(5)①根据温度对催化剂活性的影响可知在300℃时失去活性,故得出乙酸的生成速率主要取决于温度影响的范围;
②先将Cu2Al2O4拆成氧化物的形式:Cu2O•Al2O3,再根据氧化物与酸反应生成离子方程式,需要注意的是一价铜具有还原性.
解答 解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
依据盖斯定律①-②×3得到热化学方程式为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
(2)烷燃料电池以KOH溶液为电解质溶液时,负极上是CO发生失电子的氧化反应,又因为电解质是KOH溶液,二氧化碳和氢氧化钾反应得到的是碳酸钾,即CO+4OH--2e-=CO32-+2H2O,
故答案为:CO+4OH--2e-=CO32-+2H2O;
(3)①Ⅱ比Ⅰ的甲醇的物质的量少,则一氧化碳和氢气的物质的量越多,根据K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(CO)•{c}^{3}({H}_{2})}$知,平衡常数越小,故KⅠ>KⅡ,
故答案为:>;
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始:1 3 0 0
平衡:1-x 3-3x x x
甲中平衡后气体的压强为开始时的0.8倍,即(4-2x)÷4=0.8 解得x=0.4mol
依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4<n(c)≤1mol,
故答案为:0.4<n(c)≤1mol;
(4)由图2可知,在0~15h内,甲烷的物质的量变化量为△n(Ⅰ)<△n(Ⅲ)<△n(Ⅱ),故在0~15h内,CH4的平均生成速率v(Ⅱ)>v(Ⅲ)>v(Ⅰ),
故答案为:II>III>I;
(5)①温度超过250℃时,催化剂的催化效率降低,在300℃时失去活性,故以后乙酸的生成速率升高是由温度升高导致的,故乙酸主要取决于温度影响的范围为300℃~400℃,
故答案为:300℃~400℃;
②Cu2Al2O4拆成氧化物的形式:Cu2O•Al2O3,与酸反应生成离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O,
故答案为:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
点评 本题主要考查了反应热的计算、化学反应常数、化学平衡以及原电池原理的运用,掌握盖斯定律的应用、原电池的反应原理、化学平衡相关计算是解答关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 镁片插入硝酸银溶液中:Mg+2Ag+═Mg2++2Ag | |
| B. | 常温下将氯气通入水中:Cl2+H2O?H++Cl-+HClO | |
| C. | 氯气与碘化钾溶液反应:Cl2+I-═2Cl-+I | |
| D. | 大理石加到盐酸中反应:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1 | B. | 0.15mol•L-1 | C. | 0.04mol•L-1 | D. | 0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 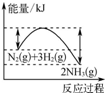 如图反应达到平衡后,升高温度,平衡向生成氨气的方向移动 | |
| B. |  如图表示镁条放入盐酸中生成氢气的速率受温度和浓度的影响 | |
| C. |  如图表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量变化 | |
| D. | 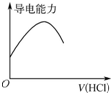 如图表示向氨水中通入HCl气体,溶液的导电能力变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若正反应是吸热反应,则A为气态 | |
| B. | 若正反应是放热反应,则A为气态 | |
| C. | 改变压强对平衡的移动无影响 | |
| D. | 在平衡体系中加入少量C,则平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-丁烯使溴水褪色,乙炔制取氯乙烯 | |
| B. | 苯乙烯制取聚苯乙烯,四氟乙烯制取聚四氟乙烯 | |
| C. | 1-己烯使KMnO4酸性溶液褪色,甲苯使KMnO4酸性溶液褪色 | |
| D. | 由氯代环己烷制环己烯;由丙烯制1,2-二溴丙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com