

 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Cu2+ | 4.7 | 6.7 |
| Fe3+ | 1.9 | 3.2 |
| 4.0×10-38 |
| (10-10)3 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
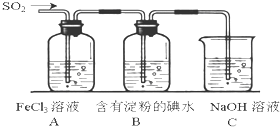 某校化学兴趣小组为探究SO2气体的还原性设计了如下装置图:
某校化学兴趣小组为探究SO2气体的还原性设计了如下装置图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
| ① | KNO3溶液 | KOH | 加入FeCl3溶液,并过渡 |
| ② | Al2(SO4)3溶液 | MgSO4 | 加入过量烧碱后过滤,再用硫酸酸化滤液 |
| ③ | CO2 | SO2 | 通过盛KMnO4(H+)溶液烧洗气瓶,再通过浓硫酸的洗气瓶 |
| ④ | NaNO3 | CaCO3 | 溶解、过滤、蒸发结晶 |
| A、①②④ | B、③④ |
| C、②③④ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A、上述反应△H<0 |
| B、上述反应△H>0 |
| C、a>b |
| D、a<b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com