
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况),实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大_______min(填0~1、1~2、2~3、3~4、4~5)。反应开始后反应速率先增大的原因是__________。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率_______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入少量的下列溶液以减慢反应速率,你认为不可行的是(_______)
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图

①该反应的化学方程式是____________。
②该反应达到平衡状态的标志是_________。
A.X、Y、Z的反应速率相等 B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变 D.生成1mol Y的同时生成2mol Z
③2min内X的转化率为__________。
【答案】2~3min 因为反应开始阶段温度对反应的速率起决定性的作用,反应是放热反应,升高温度,反应速率增大 0.025mol/(L·min) CD 3X(g)+Y(g)![]() 2Z(g) CD 30%
2Z(g) CD 30%
【解析】
(1)①在0~1、1~2、2~3、3~4、4~5min时间段中产生气体的体积判断,根据金属与酸的反应为放热反应分析解答;②计算出氢气的体积,根据2HCl~H2,计算消耗盐酸的物质的量,计算浓度的变化,根据v=![]() 计算反应速率;
计算反应速率;
(2)为了减缓反应速率但不减少产生氢气的量,可降低H+浓度,但不能影响H+的物质的量;
(3)①根据图像判断出反应物和生成物,以及参加反应的物质的物质的量之比书写化学方程式;②根据反应到达平衡状态的特征分析判断;③根据转化率=![]() ×100%计算。
×100%计算。
(1)①在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为100mL、140mL、224mL、112mL、54mL,由此可知反应速率最大的时间段为2~3min;因为该反应是放热反应,开始阶段温度对反应的速率起决定性的作用,温度越高,反应速率越大,故答案为:2~3min;因为反应开始阶段温度对反应的速率起决定性的作用,反应是放热反应,升高温度,反应速率增大;
②在3~4min时间段内,n(H2)=![]() =0.005mol,根据2HCl~H2,计算消耗盐酸的物质的量为0.01mol,则υ(HCl)=
=0.005mol,根据2HCl~H2,计算消耗盐酸的物质的量为0.01mol,则υ(HCl)= =0.025mol/(Lmin),故答案为:0.025mol/(Lmin);
=0.025mol/(Lmin),故答案为:0.025mol/(Lmin);
(2)A.加入蒸馏水,H+浓度减小,反应速率减小,且不减少产生氢气的量,故A可行;B.加入KCl溶液,H+浓度减小,反应速率减小且不减少产生氢气的量,故B可行;C.加入KNO3溶液,H+浓度减小,因酸性溶液中有NO3-,具有强氧化性,与Zn反应无氢气生成,故C不可行;D.加入CuSO4溶液,Zn置换出Cu反应速度增大,且影响生成氢气的量,故D不可行;故答案为:CD;
(3)①由图像可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物。当反应进行到5min时,△n(Y)=0.2mol,△n(Z)=0.4mol,△n(X)=0.6mol,则△n(Y)∶△n(Z)∶△n(X)=1∶2∶3,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为:3X(g)+Y(g)![]() 2Z(g),故答案为:3X(g)+Y(g)
2Z(g),故答案为:3X(g)+Y(g)![]() 2Z(g);
2Z(g);
②A.X、Y、Z的反应速率相等,不能说明是否变化,不能作平衡状态的标志,故A错误;B.随着反应的进行,X、Y的反应速率比始终为3∶1,不能作为平衡状态的标志,故B错误;C.体积固定,混合气体的总物质的量不确定,当容器的压强保持一定,说明正逆反应速率相等,反应达到平衡状态,故C正确;D.生成1molY的同时生成2molZ,正逆反应速率相等,反应达到平衡状态,故D正确;故答案为:CD;
③2min内X的转化率为![]() ×100%=30%,故答案为:30%。
×100%=30%,故答案为:30%。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO45H2O(s)═CuSO4(s)+5H2O(l)△H=+Q2kJmol-1则Q1、Q2的关系为
A. Q1<Q2 B. Q1>Q2 C. Q1=Q2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中溴含量约为65mg·L-1,从海水中提取溴的工艺流程如下:
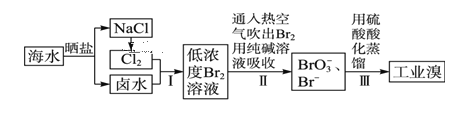
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是_______。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的__________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在下面横线上填入适当的化学计量数:_____Br2+_____CO32-=_____ BrO3-+_____Br-+_____CO2↑
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:__________。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是__________。
A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是
A. H2O(g)===H2+1/2O2(g)ΔH=-485 kJ·mol-1
B. H2O(g)===H2(g)+1/2O2(g) ΔH=+485 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是常见的过渡金属之一,研究铬的性质具有重要意义。
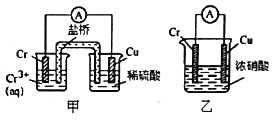
(1)在上图装置中,观察到装置甲铜电极上产生大量的无色气体;而装置乙中铜电极上无气体产生,铬电极上产生大量红棕色气体。由此可得到的结论_______________。
(2)工业上使用下图装置,采用石墨作电极电解Na2CrO4溶液,使Na2CrO4转化为Na2Cr2O7,其转化原理为_____。

(3)CrO3和K2Cr2O7均易溶于水,它们是工业废水造成铬污染的主要原因。要将Cr(VI)转化为Cr(III)常见的处理方法是电解法和铁氧磁体法。
①电解法:将含Cr2O72-的废水通入电解槽内,用铁作阳极,在酸性环境中,加入适量的NaC1进行电解,使阳极生成的Fe2+和Cr2O72-发生反应,其离子方程式为___________。阴极上Cr2O72-、H+、Fe3+都可能放电。若Cr2O72-放电,则阴极的电极反应式为_________;若H+放电,则阴极区形成Fe(OH)3和Cr(OH)3沉淀。
②铁氧磁体法:在含Cr(VI)的废水中加入绿矾,在pH<4时发生反应使Cr(VI)转化为Cr(III),调节溶液pH为6~8,使溶液中的Fe(I)、Fe(Ⅱ)、Cr(III)析出组成相当于Fe(Ⅱ)[Fe(III)x·Cr (III)2-x]O4(铁氧磁体 的沉淀,则铁氧磁体中x=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2) ![]() 0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
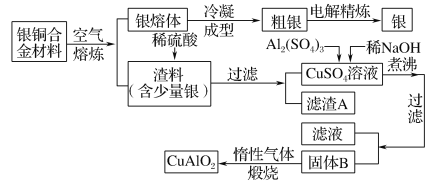
[注:Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃]
(1)电解精炼银时,阴极反应式为___________________________。
滤渣A与稀硝酸反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为________________________。
(2)固体混合物B的组成为________;
(3)完成煅烧过程中一个反应的化学方程式:__
________CuO+________Al2O3![]() ________CuAlO2+________。
________CuAlO2+________。
(4)CuSO4溶液也可用于制备胆矾,其基本操作是____________、过滤、洗涤和干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把3mol P和2.5mol Q置于2L密闭容器中,发生如下反应:3P(g)+Q(g)![]() xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(L·min),下列叙述错误的是
xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(L·min),下列叙述错误的是
A. 5min内P的平均反应速率为0.15mol/(L·min)
B. Q的平衡浓度为1mol/L
C. Q的转化率为25%
D. x是2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com