
【题目】如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.试回答: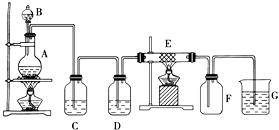
(1)C、G两个装置所盛放的试剂分别是:
CG .
(2)①装置搭好须进行气密性检查,写出操作方法: .
②两处酒精灯应先点燃处(填写A或B),目的是 .
③F中的现象为 , G中出现了一种沉淀,该沉淀的化学式 .
(3)写出在A、E中发生反应的化学方程式为:
A: .
E: .
【答案】
(1)饱和食盐水,氢氧化钠溶液
(2)关闭分液漏斗活塞,往烧杯G中加水,微热A处酒精灯,烧杯中有气泡产生,停止加热冷却后,导管中形成一段水柱,A,赶走空气,防止铁被空气氧化,产生棕黄或棕红或棕褐色的烟,Fe(OH)3
(3)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,2Fe+3Cl2
MnCl2+Cl2↑+2H2O,2Fe+3Cl2 ![]() 2FeCl3
2FeCl3
【解析】解:(1)浓盐酸易挥发,制备的氯气中含有氯化氢,氯气在饱和氯化钠溶液中溶解度小,氯化氢易溶于水,可用饱和氯化钠溶液除去氯气中的氯化氢;氯气有毒,应进行尾气处理,氯气能够与氢氧化钠,被氢氧化钠溶液液吸收;
(2)①装置气密性检查方法:关闭分液漏斗活塞,往烧杯G中加水,微热A处酒精灯,烧杯中有气泡产生,停止加热冷却后,导管中形成一段水柱;
②装置中有空气,为防止空气中的氧气氧化铁,应先制备氯气,用氯气排尽装置中的空气,所以应先点燃A处酒精灯;
③铁与氯气反应生成氯化铁,F收集氯化铁,现象为:产生产生棕黄或棕红或棕褐色的烟;氯化铁与G中的氢氧化钠反应生成氢氧化铁沉淀;
(3)浓盐酸与二氧化锰在加热条件下反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl( 浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
铁在氯气中燃烧生成氯化铁,化学方程式:2Fe+3Cl2 ![]() 2FeCl3;
2FeCl3;
故答案为:(1)饱和食盐水;氢氧化钠溶液;(2)①关闭分液漏斗活塞,往烧杯G中加水,微热A处酒精灯,烧杯中有气泡产生,停止加热冷却后,导管中形成一段水柱;②A;赶走空气,防止铁被空气氧化;③产生棕黄或棕红或棕褐色的烟; Fe(OH)3;(3)MnO2+4HCl( 浓) ![]() MnCl2+Cl2↑+2H2O;2Fe+3Cl2
MnCl2+Cl2↑+2H2O;2Fe+3Cl2 ![]() 2FeCl3
2FeCl3
(1)C装置的作用主要用于除去氯气中混有的HCl;G装置主要用于尾气吸收,用NaOH溶液吸收多余的氯气。
(2)①检查装置气密性时,应先关闭分液漏斗活塞,通过装置AG的现象确定装置的气密性。
②铁的活动性较强,加热前应先排除装置内的空气。
③装置F中会有氯化铁生成;装置G的试剂为NaOH,易与FeCl3反应生成红褐色沉淀。
(3)装置A为实验室制取氯气的反应;装置E为铁与氯气的反应。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】现有25℃时0.1mol/L的氨水,请回答以下问题:
①若向氨水中加入少量硫酸铵固体,此时溶液中 ![]() (填“增大”,“减小”或“不变”).
(填“增大”,“减小”或“不变”).
②若向氨水中加入稀硫酸,使其恰好中和,所得溶液的pH7(填“>”“<”或“=”),用离子方程式表示其原因: .
③若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42﹣)为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;V、VI是气体收集装置,根据要求回求答下列问题: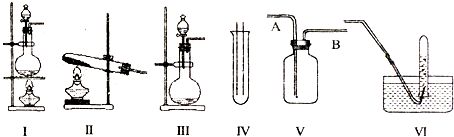
(1)气体发生装置的选择:若用CaCO3与盐酸反应制CO2 , 则可选择;(填序号)若用I装置制取氯气,则浓盐酸应盛放在(填I中的仪器名称).写出实验室制取氯气的化学方程式 .
(2)收集装置的选择:若选用V为氯气收集装置,则氯气应从口通入.用化学方法检验氯气收集满的方法是 .
(3)实验室制取氯气,多余的氯气要进行尾气处理,一般将尾气通入到溶液中,其发生反应的化学方程式为 .
(4)气体的吸收:若经试验发现,现1体积的水已吸收336体积的HCl,且得到的溶液的密度为1.08g/cm3 , 则所得溶液中溶质的物质的量浓度为mol/L.(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铂丝做焰色反应实验,每次做完后都需要( )
A. 用硫酸洗涤,再用自来水洗净后使用
B. 用硫酸洗涤,再灼烧至跟酒精灯火焰颜色相同后再使用
C. 用盐酸洗涤,再用自来水洗净后使用
D. 用盐酸洗涤,再灼烧至跟酒精灯火焰颜色相同后再使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空:
(1)容量瓶上含有下列量中的(填写字母) .
A.压强
B.温度
C.容积
D.密度
E.刻度线
(2)用浓硫酸配制250mL2molL﹣1硫酸溶液时,所需的玻璃仪器除烧杯、玻璃棒和胶头滴管之外,还需要(填仪器名称);在下列配制过程示意图中,有错误的是(填写序号) . 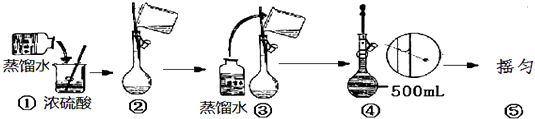
(3)现要用容量瓶配制500mL 0.4molL﹣1 Na2CO3溶液,配好的溶液倒入试剂瓶后需要贴上标签.请你帮助把如图标签上的内容填上去.
(4)下列情况将使配制溶液的物质的量浓度偏低的有(填序号).
A.容量瓶用蒸馏水洗净后,未待干燥便用来配制
B.NaOH溶解后趁热移入容量瓶中
C.定容时,俯视刻度线
D.摇匀后发现液面未到刻度线,继续加水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水泥和冶金工厂常用高压电对气溶胶作用,除去大量烟尘,以减少对空气的污染。这种做法应用的主要原理是
A. 电泳B. 渗析C. 凝聚D. 丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质间的反应,其能量变化符合如图所示的是( ) 
A.铝粉与氧化铁在加热条件下的反应
B.灼热的碳与二氧化碳反应
C.Ba(OH)28H2O晶体和NH4Cl晶体混合
D.碳与水高温条件下制取水煤气的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验). 
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a.
Ⅳ.…
(1)A中产生的是黄绿色气体,其电子式是 , 在该反应中浓盐酸表现了性和性.
(2)验证氯气的氧化性强于碘的实验现象是 .
(3)B中溶液发生反应的离子方程式是 .
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 .
(5)过程Ⅲ实验的目的是 .
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 , 得电子能力逐渐减弱.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com