
| A. |  为证明非金属性强弱:S>C>Si | |
| B. | 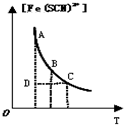 表示可逆反应Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)平衡时,物质的量浓度[Fe(SCN)2+]与温度T的关系,反应处于D点时,一定有V(正)<V(逆) | |
| C. | 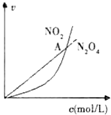 表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| D. | 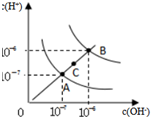 为水的电离平衡曲线图,若从A点到C点,可在水中加入适量NaOH固体 |
分析 A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸;
B.D在曲线下方,不是平衡状态,c[Fe(SCN)2+]比平衡状态小,应向正反应方向移动;
C.可逆反应2NO2?N204(g)中,分析判断 二氧化氮消耗速率和四氧化二氮的消耗速率之比为2:1,说明反应达到平衡状态;
D.C点离子积常数大于A,则C点温度高于A,加入NaOH固体不能实现从A点到C点.
解答 解:A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,硫酸和碳酸钠反应生成碳酸、碳酸和硅酸钠反应生成硅酸,所以能说明非金属性S>C>Si,故A正确;
B.D在曲线下方,不是平衡状态,c[Fe(SCN)2+]比平衡状态小,应向正反应方向移动,V正>V逆,故B错误;
C.可逆反应2NO2?N204(g)中,分析判断,二氧化氮消耗速率和四氧化二氮的消耗速率之比为2:1时才能说明反应达到平衡状态,交点只是浓度相同不能证明达到终点,故C错误;
D.C点离子积常数大于A,则C点温度高于A,加入NaOH固体,溶液中氢氧根离子浓度增大、氢离子浓度减小,不符合图象,所以不能实现从A点到C点,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及非金属性强弱判断、化学平衡状态判断等知识点,侧重考查学生图象分析及判断能力,明确图中曲线变化趋势及变化原理是解本题关键,易错选项是D.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象 | 解释或结论 |
| A | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中龠Na+,不含K+ |
| B | 向某溶液中滴加KSCN溶液,无明显现象,再滴加 少量氯水,溶液变成红色 | 溶液中含有Fe2+,没有Fe3+ |
| C | 向苯中滴入少量浓溴水,振荡,精置分层,上层呈橙红色,下层几乎无色 | 苯和溴水发生取代反应,使溴水褪色 |
| D | 在少量无水乙醇中加入金属Na+,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯食品袋耐高温加热 | |
| B. | 石英玻璃仪器耐酸碱腐蚀 | |
| C. | 羊毛织物可用强碱性洗涤剂清洗 | |
| D. | 把铅加入锡中制造焊锡的目的是降低熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
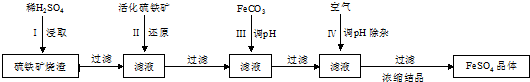
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
| $\frac{P}{{P}_{0}}$ | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
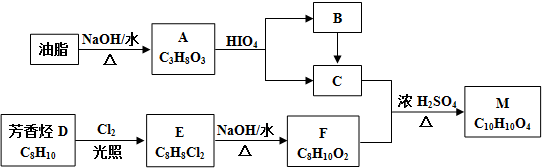
 $\stackrel{HIO_{4}}{→}$
$\stackrel{HIO_{4}}{→}$  +
+
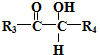 $\stackrel{HIO_{4}}{→}$R3COOH+
$\stackrel{HIO_{4}}{→}$R3COOH+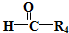
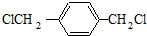 .
.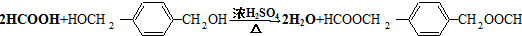 .
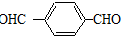
.
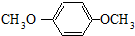

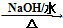 HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO
HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO 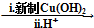 HCOOH
HCOOH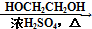 HCOOCH2CH2OOCH.
HCOOCH2CH2OOCH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com