
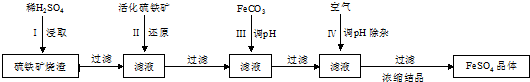
分析 硫铁矿烧渣用硫酸浸取,过滤后滤液中含有硫酸铁、未反应的硫酸,用活化硫铁矿还原Fe3+后过滤,向滤液中加入FeCO3调节溶液pH,过滤后在通入空气、调节溶液pH,除去溶液中杂质离子,过滤浓缩结晶得到FeSO4晶体.
(1)用KSCN 溶液检验第Ⅱ步中Fe3+是否完全还原;
(2)氧气可以讲亚铁离子氧化为铁离子,铁离子水解使溶液pH降低;
(3)发生反应:4FeCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+4CO2,根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,构造目标热化学方程式;
(4)电池放电时的总反应为:4Li+FeS2═Fe+2Li2S,正极发生还原反应,FeS2获得电子生成Fe、S2-;
(5)发生反应4FeS2+11O2=2Fe2O3+8SO2,2SO2+O2=2SO3,SO3+H2O=H2SO4,依据元素守恒和转化率结合化学方程式定量关系计算;
解答 解:硫铁矿烧渣用硫酸浸取,过滤后滤液中含有硫酸铁、未反应的硫酸,用活化硫铁矿还原Fe3+后过滤,向滤液中加入FeCO3调节溶液pH,过滤后在通入空气、调节溶液pH,除去溶液中杂质离子,过滤浓缩结晶得到FeSO4晶体.
(1)KMnO4溶液、K3[Fe(CN)6]溶液可以检验有Fe2+生成,取第Ⅱ步反应中溶液少许与试管中,滴加KSCN 溶液,若溶液不变红色,说明Fe3+完全被还原,
故答案为:C;
(2)氧气可以将Fe2+离子氧化为Fe3+离子,Fe3+离子水解生成H+,使溶液pH降低,
故答案为:氧气可以将Fe2+离子氧化为Fe3+离子,Fe3+离子水解生成H+;
(3)发生反应:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,
已知:①4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
②C(s)+O2(g)═CO2(g)△H=-393kJ/mol
③2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
根据盖斯定律,①-③×2+②×④可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),故△H=-1648kJ/mol-2×(-1480kJ/mol)+4×(-393kJ/mol)=-260kJ/mol,
故反应热化学方程式为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol,
故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol;
(4)电池放电时的总反应为:4Li+FeS2═Fe+2Li2S,正极发生还原反应,FeS2获得电子生成Fe、S2-,正极电极反应式为:FeS2+4e-=Fe+2S2-,
故答案为:FeS2+4e-=Fe+2S2-;
(5)4FeS2+11O2=2Fe2O3+8SO2,2SO2+O2=2SO3,SO3+H2O=H2SO4,已知该硫铁矿样品中FeS2的质量分数为90.0%,假设杂质不参加反应,煅烧10t该硫铁矿,理论上产生SO2的体积(标准状况)为x,生成98%的硫酸质量为y:
FeS2~~~~2SO2~~~~2H2SO4
120 2×22.4 2×98
1×107g×90% V m×98%
V=3.36×106 L
m=1.5×107g=15t
故答案为:3.36×106;15.
点评 本题以化学工艺流程为载体,考查离子方程式书写、离子检验、热化学方程式书写、电极反应式、化学计算等,需要学生熟练掌握元素化合物知识,(5)中计算为易错点、难点,注意利用守恒法计算,避免计算繁琐,较好的考查学生分析计算能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
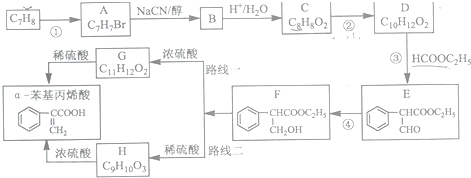


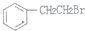 制备
制备 的合成路线.
的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10有三种同分异构体 | |
| B. | 乙醇、乙二醇、丙三醇互为同系物,同系物之间不可能为同分异物体 | |
| C. | 常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应 | |
| D. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
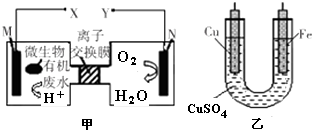
| A. | 铜电极应与X相连接 | |
| B. | H+透过离子交换膜由N极向M极移动 | |
| C. | M电极反应式:(C6H10O5)n+7n H2O-24n e-═6n CO2↑+24n H+ | |
| D. | 当N电极消耗0.25 mol气体时,则铁电极增重16 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| B. | $\frac{{k}_{W}}{c({H}^{+})}$=1×10-13 mol/L的溶液中:NH4+、Na+、SiO32-、Cl- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  为证明非金属性强弱:S>C>Si | |
| B. | 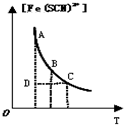 表示可逆反应Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)平衡时,物质的量浓度[Fe(SCN)2+]与温度T的关系,反应处于D点时,一定有V(正)<V(逆) | |
| C. | 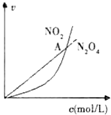 表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| D. | 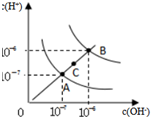 为水的电离平衡曲线图,若从A点到C点,可在水中加入适量NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物的秸秆、枝叶、杂草和人畜粪便等生物质在沼气池中经发酵可生成沼气 | |
| B. | Al(OH)3、Fe(OH)3等胶体具有很强的吸附能力,可用于净水 | |
| C. | 鸡蛋清中加入浓食盐水析出沉淀、75%乙醇溶液进行消毒、福尔马林用于浸制生物标本,其中蛋白质都发生了变性 | |
| D. | 塑料袋、废纸、旧橡胶制品等属于有机物,可以回收利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 食品化学家A.Saari Csallany和Christine Seppanen说,当豆油被加热到油炸温度(185℃)时,会产生如图所示高毒性物质,许多疾病和这种有毒物质有关,如帕金森症.下列关于这种有毒物质的判断正确的是( )
食品化学家A.Saari Csallany和Christine Seppanen说,当豆油被加热到油炸温度(185℃)时,会产生如图所示高毒性物质,许多疾病和这种有毒物质有关,如帕金森症.下列关于这种有毒物质的判断正确的是( )| A. | 该物质分子中含有两种官能团 | |
| B. | 该物质的分子式为C9H15O2 | |
| C. | 1mol该物质最多可以和2molH2发生加成反应 | |
| D. | 该物质不能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 序号 | CaCO3/mol | CaO/mol | CO2/mol |
| A | 0.02 | 0.02 | 0.05 |
| B | 0.02 | 0.02 | 0.03 |
| C | 0.02 | 0.02 | 0.01 |
| D | 0.02 | 0 | 0.05 |
| E | 0.02 | 0.02 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com