
【题目】下面是几种常见的化学电源示意图,有关说法不正确的是

A. 上述电池分别属于一次电池、二次电池和燃料电池
B. 干电池在长时间使用后,锌筒被破坏
C. 铅蓄电池工作过程中,每通过2mol电子,负极质量减轻207g
D. 氢氧燃料电池是一种具有应用前景的绿色电源
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列因果关系表述正确的是( )
A. 硅晶体具有半导体性能,可用于光导纤维
B. NH3易溶于水,可用作制冷剂
C. 铁比铜金属性强,可用FeCl3腐蚀Cu刻制印刷电路板
D. 氯水中的次氯酸具有氧化性,可用于自来水的杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取 50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH 溶液,并用另一温度计测出其温度;③将 NaOH 溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
回答下列问题:
(1)倒入 NaOH 溶液的正确操作是_____(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与 NaOH 溶液混合均匀的正确操作是_____(填序号)。
A.用温度计小心搅拌 B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和 1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为 ΔH1、ΔH2、ΔH3,则 ΔH1、ΔH2、ΔH3 的大小关系为______________________。
(4)假设盐酸和氢氧化钠溶液的密度都是 1 g·cm-3,又知中和反应后生成溶液的比热容 c=4.18 J·g-1·℃-1。为了计算中和热,某学生记录数据如下:
实验序号 | 起始温度 t1/ ℃ | 终止温度 t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热 ΔH=_____(结果保留一位小数)。_____(填“能”或“不能”)用 Ba(OH)2 溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.中国传统文化是人类文明的瑰宝,古代文献中记载了大量古代化学的研究成果。回答下面问题:
(1)我国最原始的陶瓷约出现在距今12000年前,制作瓷器所用的原料是高岭士,其晶体化学式是Al4[Si4O10](OH)8,用氧化物表示其组成为______________。
(2)《本草纲目》中记载:“(火药)乃焰消( KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者。”反应原理为:S+2KNO3+3C![]() K2S+N2↑+3CO2↑,该反应的氧化剂是____ ,反应转移4mol电子时,被S氧化的C有____mol。
K2S+N2↑+3CO2↑,该反应的氧化剂是____ ,反应转移4mol电子时,被S氧化的C有____mol。
(3)我国古代中药学著作《新修本草》记载的药物有844种,其中有关“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑁璃…烧之赤色…。”我国早期科技丛书《物理小适-金石类》 记载有加热青矾时的景象:“青矾厂气熏人,衣服当之易烂,载木不盛。”青矾就是绿矾( FeSO4·7H2O)。根据以上信息,写出“青矾”受热分解的化学方程式_________________。
Ⅱ.“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成VO2+。
(4)请写出金属钒与浓硝酸反应的离子方程式:_______________________________。
(5)V2O5是两性氧化物,与强碱反应生成钒酸盐(阴离子为VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出V2O5分别与烧碱溶液和稀硫酸反应生成的盐的化学式:_____________、 _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法中正确的是( )
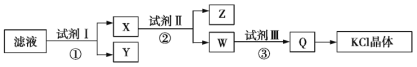
A. 始滤液的pH=7
B. 试剂Ⅰ为Ba(NO3)2溶液
C. 步骤②中加入试剂Ⅱ的目的是除去Ba2+
D. 图示步骤中的2次过滤操作不可以合并
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应能设计成原电池的是( )
A.CaCO3+2HCl═CaCl2+H2O+CO2↑B.BaCl2+Na2SO4═2NaCl+BaSO4↓
C.2NaOH+CO2═Na2CO3+H2OD.Fe+CuCl2═FeCl2+Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆 AB 两端分别挂有体积相同.质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入 M 的浓溶液,一段时间后, 下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)( )
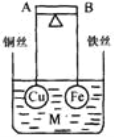
A. 当 M为盐酸、杠杆为导体时,A 端高,B 端低
B. 当 M为 AgNO3、杠杆为导体时,A 端高,B 端低
C. 当 M为 CuSO4、杠杆为导体时,A 端低,B 端高
D. 当 M为 CuSO4、杠杆为绝缘体时,A 端低,B 端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2O4(g)![]() 2NO2(g),将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
2NO2(g),将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
A. 烧瓶内气体的质量不再变化
B. 烧瓶内气体的颜色不再变化
C. 烧瓶内气体的压强不再变化
D. N2O4的消耗速率与NO2的消耗速率之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解饱和食盐水是氯碱工业基础。
(1)写出电解饱和氯化钠溶液时的总的离子反应方程式:________________________________________。
(2)当阴极产生1molH2时,通过阳离子交换膜的Na+有_________mol;
(3)产生的氯气可用于制TiCl4,但TiO2与Cl2难以直接反应,加碳生成CO、CO2可使反应得以进行。回答:
已知:TiO2(s) +2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJmol﹣1
2C(s) + O2(g)=2CO(g) △H2=﹣220.9kJmol﹣1
①TiO2与Cl2难以直接反应的原因是__________________________________________
②加碳生成CO、CO2后得以进行原因是________________________________________________________
(4)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
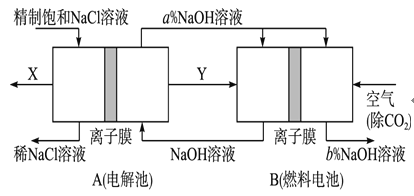
①图中Y是________ (填化学式);
②写出燃料电池B中负极上发生的电极反应:______________________________________________
③比较图示中氢氧化钠溶液质量分数的大小:a%_______b%(填>、=或<)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com