
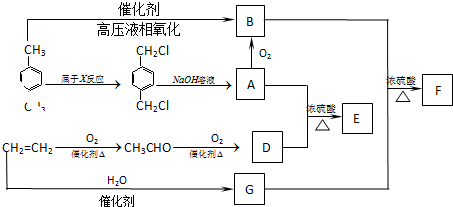
 →A:
→A: 在光照条件下发生取代反应生成
在光照条件下发生取代反应生成 ,
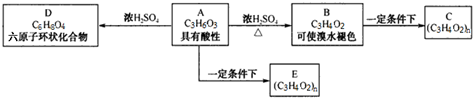
, 在氢氧化钠水溶液、加热条件下发生水解反应生成A为
在氢氧化钠水溶液、加热条件下发生水解反应生成A为 ,A发生氧化反应生成B,对二甲苯氧化也得到B,则B为
,A发生氧化反应生成B,对二甲苯氧化也得到B,则B为 .由转化关系可知,乙醛氧化生成D为CH3COOH,D与A发生酯化反应生成E为
.由转化关系可知,乙醛氧化生成D为CH3COOH,D与A发生酯化反应生成E为 .乙烯与水发生加成反应生成G为CH3CH2OH,G与B发生转化反应生成F为
.乙烯与水发生加成反应生成G为CH3CH2OH,G与B发生转化反应生成F为 ,据此解答.
,据此解答. 在光照条件下发生取代反应生成
在光照条件下发生取代反应生成 ,
, 在氢氧化钠水溶液、加热条件下发生水解反应生成A为
在氢氧化钠水溶液、加热条件下发生水解反应生成A为 ,A发生氧化反应生成B,对二甲苯氧化也得到B,则B为
,A发生氧化反应生成B,对二甲苯氧化也得到B,则B为 .由转化关系可知,乙醛氧化生成D为CH3COOH,D与A发生酯化反应生成E为
.由转化关系可知,乙醛氧化生成D为CH3COOH,D与A发生酯化反应生成E为 .乙烯与水发生加成反应生成G为CH3CH2OH,G与B发生转化反应生成F为
.乙烯与水发生加成反应生成G为CH3CH2OH,G与B发生转化反应生成F为 ,
, 在光照条件下发生取代反应生成
在光照条件下发生取代反应生成 ,故答案为:取代反应;光照;
,故答案为:取代反应;光照; 、F为
、F为 ,二者分子式相同,结构不同,互为同分异构体,均属于酯类,故选:CD;
,二者分子式相同,结构不同,互为同分异构体,均属于酯类,故选:CD; ;
; ,
, ;
; .
.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
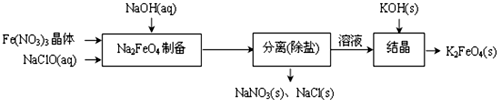
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
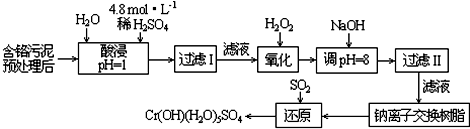
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
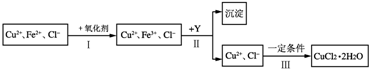
查看答案和解析>>
科目:高中化学 来源: 题型:
| 装置 | 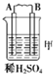 | 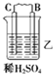 | 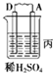 |
| 现象 | 二价金属A不断溶解 | C极质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物 质 | 除杂试剂 | 分离方法 | |
| A | Cu(Fe) | 稀硫酸 | 过滤 |
| B | Cl2(HCl) | NaOH溶液 | 洗气 |
| C | I2(CCl4) | -- | 过滤 |
| D | Br2(H2O) | 酒精 | 萃取 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com