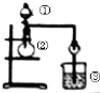
考点:原电池和电解池的工作原理,常见金属的活动性顺序及其应用
专题:电化学专题
分析:(1)甲装置中,二价金属A不断溶解说明该装置构成了原电池,且A失电子发生氧化反应而作负极,B作正极;
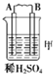
(2)乙中C的质量增加,说明C上铜离子得电子发生还原反应,则C作原电池正极,B作负极;
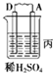
(3)丙装置中A上有气体产生,说明A上氢离子得电子发生还原反应,则A作原电池正极,D作负极,
(4)作原电池负极的金属活动性大于作正极金属,所以金属活动性强弱顺序是:D>A>B>C.
解答:
解:(1)该装置中,二价金属A不断溶解说明A失电子发生氧化反应生成金属阳离子进入溶液而作负极,所以负极电极反应式为A-2e-═A2+,
故答案为:A-2e-═A2+;
(2)乙装置中,C的质量增加说明C电极上铜离子得电子发生还原反应,则C作正极,电极反应式为Cu2++2e-═Cu,
故答案为:Cu2++2e-═Cu;
(3)丙装置中A上有气体产生,说明A上氢离子得电子发生还原反应而作正极,D作负极,正极上氢离子逐渐析出而导致氢离子浓度逐渐减小,则溶液的pH逐渐增大,
故答案为:变大;
(4)通过以上分析知,四种金属活动性强弱顺序是D>A>B>C,
故答案为:D>A>B>C.
点评:本题考查了原电池原理,根据原电池电极上得失电子来判断正负极,一般来说,作原电池负极的金属金属活动性顺序强,难度不大.



 阅读快车系列答案
阅读快车系列答案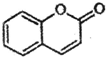 ) 是一种存在于某些植物的果、花等中的天然香料.又知:
) 是一种存在于某些植物的果、花等中的天然香料.又知: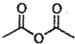 ;
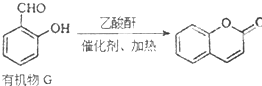
;
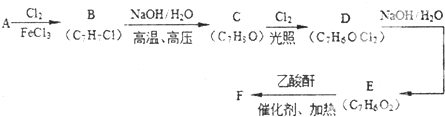
 (是一种常用有机溶剂)的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
(是一种常用有机溶剂)的合成路线流程图(无机试剂任用).合成路线流程图示例如下: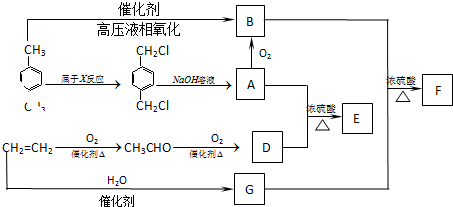
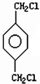 →A:
→A: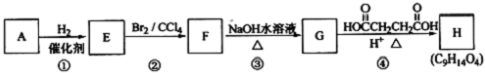

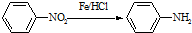 (苯胺,易被氧化)
(苯胺,易被氧化)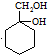 的合成路线流程图(无机试剂任用).合成路线流程图示例如:CH3CH2OH
的合成路线流程图(无机试剂任用).合成路线流程图示例如:CH3CH2OH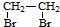

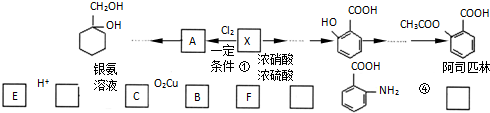
 图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2).分子内存在空腔,能嵌入某微粒并形成4个氢键予以识别.下列微粒中,能被该有机化合物识别的是( )
图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2).分子内存在空腔,能嵌入某微粒并形成4个氢键予以识别.下列微粒中,能被该有机化合物识别的是( )