
【题目】我国及美国、日本等国家都已研制出了一种陶瓷柴油机。这种柴油机的发动机部件的受热面是用一种耐高温且不易传热的材料来制造的,这种材料是( )
A. 硅钢 B. 氮化硅陶瓷 C. 光导纤维 D. 玻璃钢
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】(1)如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1∶4)的混合气体,假定氯气在水中的溶解度可以忽略。将封闭有甲烷和氯气混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间。
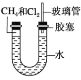
①假设甲烷与氯气反应充分,且只产生一种有机物,请写出化学方程式:_________________;
②若题目中甲烷与氯气的体积之比为1∶1,则得到的产物为____(填字母编号);
A.CH3Cl HCl B.CCl4 HCl C.CH3Cl CH2Cl2 D.CH3Cl CH2Cl2 CHCl3 CCl4 HCl
③经过几个小时的反应后,U形管右端的水柱变化是________ (填字母编号);
A.升高B.降低 C.不变D.无法确定
④若水中含有Na2SiO3,则在U形管左端会观察到__________________________________________;
⑤右端玻璃管的作用是_______________________。
(2)某实验小组用下列装置进行乙醇催化氧化的实验。
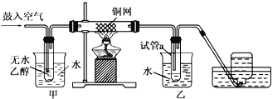
①实验过程中铜网出现红色和黑色交替出现的现象,请写出相应的化学方程式___________________、______________________ ;
②甲和乙两个装置的作用不相同,甲的作用是_____________;乙的作用是 _____________;
③反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是______________________;集气瓶收集到的气体的主要成分是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭推进器中盛有液态肼(N2H4)和氧气。当把0.2mol液态肼和足量氧气反应,生成氮气和水蒸气,放出128.8kJ的热量(相当于25℃、101kPa下测得的热量)。
(1)反应的热化学方程式为_____________________________________________。
(2)又已知H2O(l) = H2O(g)ΔH= +44kJ/mol。则16g液态肼与氧气生成液态水时放出的热量是____kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
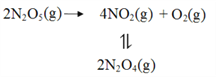
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5. | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=4.4 kJ·mol1 ,2NO2(g)=N2O4(g) ΔH 2=55.3 kJ·mol1,则反应N2O5(g)=2NO2(g)+1/2O2(g)的ΔH =_______ kJ·mol1。
②研究表明,N2O5(g)分解的反应速率v=2×10-3×P(N2O5)(KPa/min)。t=62 min时,测得体系中P(O2)=2.9 kPa,则此时的P(N2O5)=________ kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”)。
④25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应) B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效 D.第三步反应活化能较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡。

(1)该反应的化学方程式是____________。
(2)反应起始至t时刻,Y的平均反应速率是_______________。
(3)关于该反应的说法,正确的是______。
A.到达t时刻该反应已停止
B.加入催化剂,一定能加快反应速率
C.在t时刻正反应速率等于逆反应速率
D.增大压强,一定能加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。
下列说法正确的是

A. 电池内的O2-由电极乙移向电极甲
B. 电池总反应为N2H4+2O2=2NO+2H2O
C. 当甲电极上有1molN2H4消耗时,乙电极上有1mol被氧化
D. 电池外电路的电子由电极乙移向电极甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,A、B同主族,C、D同周期,B、E同周期。气体A2与气体C2混合后点燃能够发生爆炸,且产物在常温常压下是一种无色无味的液体。B、C、E简单离子的核外电子排布相同。E的最高价氧化物可与B的最高价氧化物的水化物反应生成一种易溶于水的的盐,D能形成自然界硬度最大的单质。请根据上述所提供的信息回答下列问题。
(1)写出A、B两种元素的元素名称:A________、B________写出D的最高价氧化物的电子式___________。
(2)写出由B和C两元素形成的原子个数比为1:1的化合物F存在的化学键是_______________________
(3)写出F和A2C反应的离子方程式:________________________________。
(4)潜艇中使用的液氨-液氧燃料电池工作原理如图2所示:

①电极b名称是____。
②电解质溶液中OH-离子向____移动(填“电极a”或“电极b”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同温度下,水溶液中c(H+)与c(OH-)的关系如下图所示。下列有关说法不正确的是( )
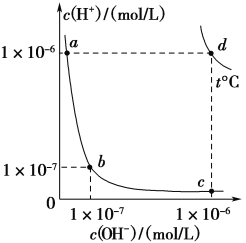
A. d点对应的食盐水pH=6,呈中性
B. 向a点对应的CH3COOH溶液中滴加NaOH溶液至b点,此时c(Na+)=c(CH3COO-)
C. 温度为t ℃时,0.05 mol/L Ba(OH)2溶液的pH=11
D. a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com