
| Y |
| 12 |
| A、-Y kJ?mol-1 |
| B、-(10X-Y) kJ?mol-1 |
| C、-(5X-0.5Y) kJ?mol-1 |
| D、+(10X-Y) kJ?mol-1 |
| ||
| ||
| ||
| ||
| 3.6g |
| 12g/mol |
| 6.4g |
| 32g/mol |
| Y |
| 12 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
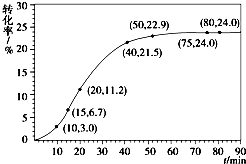 (1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙酸乙酯中残留的乙酸,可加过量饱和Na2CO3溶液振荡后,静置分液 |
| B、某烷烃主链4个碳原子数的同分异构体有2种,则与其碳原子个数相同的且主链4个碳原子的单烯烃有4种 |
C、1mol有机物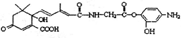 与NaOH溶液反应,最多消耗5mol NaOH 与NaOH溶液反应,最多消耗5mol NaOH |
D、有机物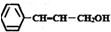 分子中所有原子在同一平面内 分子中所有原子在同一平面内 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Si是一种非金属主族元素,其氧化物可用于制作计算机芯片 |
| B、胃穿孔患者胃酸过多时,可服用含Al(OH)3的药片 |
| C、Mg、Fe等金属在一定条件下与水反应都生成H2和对应的氢氧化物 |
| D、铝粉和氧化镁粉末混合,高温能发生铝热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
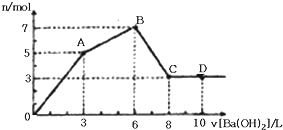
| A、OA段反应的离子方程式为:3Ba2++2Al3++8OH-+3SO42-═3BaSO4↓+2AlO2-+4H2O |
| B、向D点溶液中通入C02气体,立即产生白色沉淀 |
| C、原混合液中c[Al2(SO4)3]:c(AlCl3)═1:2 |
| D、图中C点铝元素存在形式是AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢化钙被还原 |
| B、水既是氧化剂,又是还原剂 |
| C、H2既是氧化产物,也是还原产物 |
| D、H2O发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.将NaHSO4晶体加热熔融时有两种化学键断裂 |
| B、水分子间因为存在氢键,所以加热至较高温度时也难以分解 |
| C、根据金属晶体的共性可知金属键和离子键一样没有方向性和饱和性 |
| D、以极性共价键形成的分子一定是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强 | P1 | P2 | P3 |
| 反应物转化率 | α1 | α2 | α3 |
| A、2 c1>c3 |
| B、a+b=92.4 |
| C、2P1<P3 |
| D、α1+α3=1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com