
【题目】在一定温度下,10mL 0.40mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表.
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10﹣2 mol/(Lmin)
B.6~10 min的平均反应速率:v(H2O2)<3.3×10﹣2 mol/(Lmin)
C.反应到6 min时,H2O2分解了50%
D.反应到6 min时,c(H2O2)=0.30 mol/L
【答案】D
【解析】解:A.0~6min产生的氧气的物质的量n(O2)= ![]() =0.001mol,n(H202)=2n(O2)=0.002mol,v(H202)=
=0.001mol,n(H202)=2n(O2)=0.002mol,v(H202)= ![]() mol/(Lmin)≈3.3×10﹣2 mol/(Lmin),故A正确; B.反应物浓度越大反应速率越大,随着反应进行,反应速率逐渐减小,前6min内反应速率为3.3×10﹣2 mol/(Lmin),则6~10 min的平均反应速率:v(H2O2)<3.3×10﹣2 mol/(Lmin),故B正确;
mol/(Lmin)≈3.3×10﹣2 mol/(Lmin),故A正确; B.反应物浓度越大反应速率越大,随着反应进行,反应速率逐渐减小,前6min内反应速率为3.3×10﹣2 mol/(Lmin),则6~10 min的平均反应速率:v(H2O2)<3.3×10﹣2 mol/(Lmin),故B正确;
C.6min产生的氧气的物质的量n(O2)= ![]() =0.001mol,n(H202)=2n(O2)=0.002mol,其分解率=
=0.001mol,n(H202)=2n(O2)=0.002mol,其分解率= ![]() ×100%=50%,故C正确;
×100%=50%,故C正确;
D.6min时,c(H2O2)=(0.40﹣ ![]() )mol/L=0.20mol/L,故D错误;
)mol/L=0.20mol/L,故D错误;
故选D.
A.0~6min产生的氧气的物质的量n(O2)= ![]() =0.001mol,n(H202)=2n(O2)=0.002mol,v(H202)=
=0.001mol,n(H202)=2n(O2)=0.002mol,v(H202)= ![]() mol/(Lmin);
mol/(Lmin);
B.反应物浓度越大反应速率越大,随着反应进行,反应速率逐渐减小;
C.6min产生的氧气的物质的量n(O2)= ![]() =0.001mol,n(H202)=2n(O2)=0.002mol,其分解率=
=0.001mol,n(H202)=2n(O2)=0.002mol,其分解率= ![]() ×100%;
×100%;
D.6min时,c(H2O2)=(0.40﹣ ![]() )mol/L.
)mol/L.


科目:高中化学 来源: 题型:
【题目】一定条件下,分别向容积固定的密闭容器中充入A和足量B,发生反应如下:2A(g)+B(s)![]() 2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
实验Ⅰ | 实验Ⅱ | 实验Ⅲ | |
反应温度/℃ | 800 | 800 | 850 |
c(A)起始/mol·L-1 | 1 | 2 | 1 |
c(A)平衡/mol·L-1 | .0.5 | 1 | 0.85 |
放出的热量/kJ | a | b | c |
A.实验III的化学平衡常数K<1
B.实验放出的热量关系为b>2a
C.实验III在30min达到平衡时的速率v(A)为0.005mol L-1·min-1
D.当容器内气体密度不随时间而变化时上述反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼是植物生长发育必需的微量元素之一,硼玻璃纤维用作火箭的防护材料。下列关于硼的叙述正确的是
A. 硼原子的L电子层中有2个电子 B. 硼酸是弱酸
C. 硼的金属性比铝的金属性强 D. 硼的原子半径比碳的原子半径小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、D、E、W是中学常见的四种元素,原子序数依次增大。A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,D、E位于同周期,A、D、E的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)A在元素周期表中的位置是__________________。
(2)下列事实能用元素周期律解释的是_____(填字母序号)。
a . D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
b. E的气态氢化物的稳定性小于HF
c. WE3的溶液可用于刻蚀铜制的印刷电路板
(3)E的单质可以从NaBr溶液中置换出Br2单质,从原子结构的角度解释其原因是__________。
(4)①工业上用电解法制备D的单质,反应的化学方程式为____________________。
②家用“管道通”的有效成分是烧碱和D的单质,使用时需加入一定量的水,此时发生反应的化学方程式为____________________。
(5)W的单质可用于处理酸性废水中的NO3-,使其转换为NH4+,同时生成有磁性的W的氧化物X,再进行后续处理。
① 上述反应的离子方程式为__________。
② D的单质与X在高温下反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做浓硫酸与铜反应的实验过程中,观察到铜片表面变黑,于是对黑色物质的组成进行实验探究。
(1)用如右图所示装置进行实验1。(加热和夹持仪器已略去)

实验1:铜片与浓硫酸反应
操作 | 现象 |
加热到120℃~250℃ | 铜片表面变黑,有大量气体产生,形成墨绿色浊液 |
继续加热至338℃ | 铜片上黑色消失,瓶中出现“白雾”,溶液略带蓝色,瓶底部有较多灰白色沉淀 |
①装置B的作用是________;装置C中盛放的试剂是_______。
②为证明A装置中灰白色沉淀的主要成分为硫酸铜,实验操作及现象是___________。
(2)探究实验1中120℃~250℃时所得黑色固体的成分。
【提出猜想】黑色固体中可能含有CuO、CuS、Cu2S中的一种或几种。
【查阅资料】
资料1:亚铁氰化钾[K4Fe(CN)6]是Cu2+的灵敏检测剂,向含有Cu2+的溶液中滴加亚铁氰化钾溶液,生成红棕色沉淀。
资料2:
CuS | Cu2S |
黑色结晶或粉末 | 灰黑色结晶或粉末 |
难溶于稀硫酸;可溶于硝酸;微溶于浓氨水或热的浓盐酸 | 难溶于稀硫酸和浓盐酸;可溶于硝酸;微溶于浓氨水 |
【设计并实施实验】
实验2.探究黑色固体中是否含CuO
操作 | 现象 |
i.取表面附着黑色固体的铜片5片,用清水洗干净,放入盛有10mL试剂A的小烧杯中,搅拌 | 黑色表层脱落,露出光亮的铜片 |
ii.取出铜片,待黑色沉淀沉降 | 上层溶液澄清、无色 |
①试剂A是_________。
②甲认为ii中溶液无色有可能是Cu2+浓度太小,于是补充实验确认了溶液中不含Cu2+,补充的实验操作及现象是______。
实验3.探究黑色固体中是否含CuS、Cu2S
操作 | 现象 |
i.取实验2中黑色固体少许,加入适量浓氨水,振荡后静置 | 有固体剩余,固液分界线附近的溶液呈浅蓝色 |
ii.另取实验2中黑色固体少许,加入适量浓盐酸,微热后静置 | 有固体剩余,溶液变成浅绿色 |
【获得结论】由实验2和实验3可得到的结论是:实验1中,120℃~250℃时所得黑色固体中_______。
【实验反思】
分析实验1中338℃时产生现象的原因,同学们认为是较低温度时产生的黑色固体与热的浓硫酸进一步反应造成。已知反应的含硫产物除无水硫酸铜外还有二氧化硫,则黑色固体消失时可能发生的所有反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定化学反应的离子方程式正确的是
A. 二氧化锰和浓盐酸共热: MnO2 +4HCl![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B. AlCl3溶液中滴加过量的浓氨水:Al3++4NH3·H2O=AlO![]() +4NH4++2H2O
+4NH4++2H2O
C. 将Cu2O与稀HNO3混合:3Cu2O+14H++2NO![]() ===6Cu2++2NO↑+7H2O
===6Cu2++2NO↑+7H2O
D. 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的性状 | 温度/ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m4 |
6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(1)化学反应速率本质上是由决定的,但外界条件也会影响反应速率的大小.本实验中实验2和实验3表明对反应速率有影响.
(2)我们最好选取实验(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的反应速率越快.
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快.原因是 .
(4)利用表中数据,可以求得:硫酸的物质的量浓度是mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,几种弱酸的电离平衡常数如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三种酸中酸性最弱的是__________(填化学式)。
(2)CH3COOH的电离平衡常数表达式为K=__________。
(3)写出H2CO3的第二步电离方程式:_____________。
(4)写出H2SO3溶液和CH3COONa溶液反应的离子方程式:____________________。
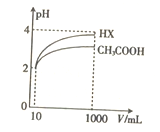
(5)将体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图所示,则HX的电离平衡常数____________(填“大于”“ 小于”或“等于”)醋酸的电离平衡常数,理由是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com