
 (1)已知:①C(s)+O2(g)=CO2(g)△H=a kJ•mol-1
(1)已知:①C(s)+O2(g)=CO2(g)△H=a kJ•mol-1| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| 平均值 | |||||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
分析 (1)结合盖斯定律可知,③+①×2-②得到TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g),以此来解答;
(2)①依据量取溶液的体积选择合适的量筒;
②中和热测定实验成败的关键是减少热量的损失;
③中和热的测定中,完全反应后混合溶液的最高温度为终止温度;
④先判断数据的有效性,然后计算出平均温度差,再根据Q=m•c•△T计算反应放出的热量;
⑤根据弱电解质电离吸热分析.
解答 解:(1)由①C(s)+O2(g)=CO2(g)△H=a kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=b kJ•mol-1;
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g)△H=c kJ•mol-1;
结合盖斯定律可知,③+①×2-②得到TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)△H=(c+2a-b)kJ•mol-1;
故答案为:c+2a-b;
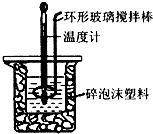
(2)①在该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪是50ml量筒和胶头滴管;
故答案为:50ml量筒;
②中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失;
故答案为:减少实验过程中的热量损失;
③中和热的测定中,完全反应后混合溶液的最高温度为终止温度;
故答案为:混合溶液的最高;
④第三次得到温度差误差较大,应该舍弃,所以平均温度差为:$\frac{3.25℃+3.15℃}{2}$=3.2℃,溶液的质量为100ml×1g/ml=100g,则该反应中放出的热量为:Q=m•c•△T=100g×4.2J/(g•℃)×3.2℃=1344J;
故答案为:1344;
⑤一水合氨为弱碱,电离过程为吸热过程,放出的热量偏少,但中和热△H为负值,用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热偏大;
故答案为:偏大;一水合氨为弱电解质,反应过程中电离需要吸收热量,故放出的热量偏少,△H偏大;
点评 本题考查了盖斯定律计算反应热,中和热的测定,明确中和热的测定步骤为解答关键,注意掌握中和热计算方法,试题培养了学生的分析能力及化学实验能力,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 一定含有Al,其质量为2.7g | |
| B. | 一定不含有FeCl2,含有少量AlCl3 | |
| C. | 混合物中含有0.05molMgCl2 | |
| D. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与过量稀硫酸反应:Ba2++OH-+SO42-+H+=H2O+BaSO4↓ | |
| B. | 碳酸氢钙与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 氯化镁溶液与过量的氨水反应:Mg2++2OH-=Mg(OH)2↓ | |
| D. | 稀硫酸与过量的铁屑反应:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下1L0.1mol•L-1NH4NO3溶液中的氮原子数为0.2NA | |
| B. | 含1molH2SO4的浓硫酸和足量的锌完全反应,转移的电子数为2NA | |
| C. | A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,且D为强电解质(其他相关物质可能省略):A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{H_{2}O}{→}$D,若A是共价化合物,0.1molA分子中含有的质子数可能为NA | |
| D. | 用足量CO还原磁铁矿得到9mol铁时转移24mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
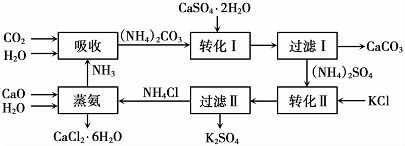
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解得量(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 装置 | 操作 | 现象 |
 | 添加试剂,检查装置气密性,点燃酒精灯 | i.C中气体颜色变浅 ii.稍后,C中出现白烟并逐渐增多 |

 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com