
| 装置 | 操作 | 现象 |
 | 添加试剂,检查装置气密性,点燃酒精灯 | i.C中气体颜色变浅 ii.稍后,C中出现白烟并逐渐增多 |

 .
.
分析 (1)氯化铵和氢氧化钙加热发生复分解反应,生成氯化钙、氨气和水;
(2)用碱石灰干燥氨气;
(3)①氨气是氮原子和三个氢原子形成三个共价键,氮原子有一对孤对电子,据此书写电子式;
②化学反应的焓变=反应物键能总和-生成物键能总和计算;依据原子半径分析,键越短键越牢固;
(4)氨气被氯气氧化生成氮气和氯化氢,氨气过量和生成的氯化氢反应生成固体氯化铵白色固体颗粒;
(5)装置为原电池反应,钠离子移向可知a为负极,氨气失电子生成氮气,b为正极,氯气得到电子生成氯离子.
解答 解:(1)A中是氯化铵和氢氧化钙加热发生复分解反应,生成氯化钙、氨气和水,方程式为:化学反应方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
(2)氨气用碱石灰干燥,所以B中干燥管中应选用的药品为碱石灰;
故选c;
(3)①氨气中氮原子和3个氢原子形成3个共价键,氮原子有1对孤对电子,电子式为: ;
;
故答案为: ;
;
②焓变=反应物键能总和-生成物键能总和,6×(H-N)+3Cl-Cl-[6(H-Cl)+N≡N]=-456kJ•mol-1;得到6×(H-N)+3×243KJ/mol-[6(H-Cl)+945KJ/mol]=-456kJ•mol-1;得到6×(H-N)-6(H-Cl)=-456kJ•mol-1-3×243KJ/mol+945KJ/mol;(H-N)-(H-Cl)=-40KJ/mol,断开1mol H-N键与断开1mol H-Cl键所需能量相差约为40KJ;
故答案为:40KJ;
(4)氨气被氯气氧化生成氮气和氯化氢,3Cl2+2NH3=N2+6HCl,氨气过量和生成的氯化氢反应生成固体氯化铵白色固体颗粒,方程式为NH3+HCl=NH4Cl;
故答案为:HCl+NH3=NH4Cl;
(5)①装置为原电池反应,钠离子移向可知a为负极,氨气失电子生成氮气,b为正极,氯气得到电子生成氯离子,发生还原反应;
故答案为:还原;
②石墨a电极为负极,氨气失电子生成氮气,碱溶液中电极反应式为2NH3+6OH--6e-=N2+6H2O;
故答案为:2NH3+6OH--6e-=N2+6H2O.
点评 本题考查了物质性质与应用,键能和焓变的计算依据和方法,原电池电极反应书写方法,掌握物质性质和反应原理是解题关键,题目难度中等.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 气体的密度不再变化 | B. | NH3和 NO 的反应速率相等 | ||
| C. | 反应速率不再变化 | D. | NO 和H2O 浓度比不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
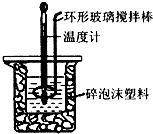 (1)已知:①C(s)+O2(g)=CO2(g)△H=a kJ•mol-1
(1)已知:①C(s)+O2(g)=CO2(g)△H=a kJ•mol-1| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| 平均值 | |||||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2→H2SiO3 | B. | Cu→CuSO4 | C. | Fe→FeCl2 | D. | Al→Na[Al(OH)4] |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 二氯化二硫(S2Cl2)是基本有机化工的直接原料,实验室可采用干燥的氯气在110℃-140℃与硫反应,即可得S2Cl2粗品.
二氯化二硫(S2Cl2)是基本有机化工的直接原料,实验室可采用干燥的氯气在110℃-140℃与硫反应,即可得S2Cl2粗品.| 物质 | S | SCl2 | S2Cl2 |
| 熔点/℃ | 112.8 | -78 | -77 |
| 沸点/℃ | 444.6 | 59.6 | 137 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
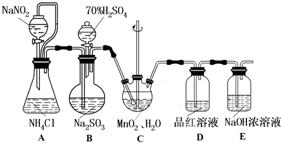
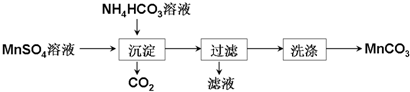
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用金属钠或者金属钾 | B. | 利用质谱法 | ||
| C. | 利用红外光谱法 | D. | 利用核磁共振氢谱 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为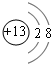 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①⑤ | B. | ②④ | C. | ①③⑤ | D. | ①②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com