
【题目】石油是重要的能源和宝贵的资源,人们的衣、食、住、行、用很大程度上直接或间接与石油产品有关。塑料、合成橡胶、合成纤维三大合成材料,绝大部分靠石油来生产。石油必须经过炼制才能使用,石油的炼制主要有分馏、裂化、重整、精制等。
煤是另一种矿物燃料,也是宝贵的资源。它是由有机物和无机物所组成的复杂的混合物。煤的综合利用有煤的气化、煤的干馏、煤的液化等。
①煤的气化是让固体煤在一定温度及压强下与气化剂(如蒸汽、空气或氧气等)发生一系列化学反应,使煤中的有机物转化为氢气、甲烷和一氧化碳等气态物质的过程。②煤的干馏是把煤隔绝空气加强热使它分解的过程。煤通过干馏产生焦炭、煤焦油、粗氨水和焦炉气等,其中煤焦油可以通过分馏制得重要的化工原料。③煤的液化是把煤磨成粉末后和一些燃料油混合,在催化剂作用下加氢,得到的液化产物的过程。此液化产物也称人造石油。
阅读上述文字,结合已学知识,回答下列问题:
(1)下列变化属于物理变化的是________________________
①石油的分馏;②煤的干馏;③石蜡的催化裂化;④煤的气化;⑤煤的液化;⑥煤焦油成分的分离。
(2)有下列反应:①由乙烯制乙醇 ②甲烷在空气中燃烧 ③由氯乙烯制聚氯乙烯 ④丙烯使溴水褪色 ⑤苯与浓硝酸、浓硫酸的混合在50℃—60℃条件下的反应 ⑥由乙烯制聚乙烯 ⑦乙醇在铜作催化剂条件下与氧气反应生成乙醛 ⑧乙醇与乙酸反应生成乙酸乙酯。
其中属于取代反应的是(填序号,下同)_______,属于氧化反应的是________,属于聚合反应的是_______,属于加成反应的是_______。
(3)![]() 分子结构中在同一平面上的碳原子数最多为______个。
分子结构中在同一平面上的碳原子数最多为______个。
(4)石油分馏产品之一的汽油中含有戊烷,戊烷分子式为C5H12。写出戊烷的所有同分异构体_____________
【答案】①⑥ ⑤⑧ ②⑦ ③⑥ ①④ 11 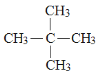
![]() CH3CH2CH2CH2CH3
CH3CH2CH2CH2CH3
【解析】
(1)①石油的分馏是利用各组分沸点不同分离,是物理变化;②煤的干馏是隔绝空气加强热使之分解,是化学变化;③石蜡的催化裂化是分子量大、沸点高的断裂为分子量小、沸点低的烃,是化学变化;④煤的气化是煤与水反应生成CO和氢气,是化学变化;⑤煤的液化是煤转变为液体燃料或物质,是化学变化;⑥煤焦油成分的分离是利用沸点不同进行分离,是物理变化。
(2)①由乙烯制乙醇是加成反应;②甲烷在空气中燃烧是燃烧反应,也是氧化反应,③由氯乙烯制聚氯乙烯是加聚反应;④丙烯使溴水褪色是发生加成反应;⑤苯与浓硝酸、浓硫酸的混合在50℃—60℃条件下的反应生成硝基苯,是取代反应;⑥由乙烯制聚乙烯是加聚反应;⑦乙醇在铜作催化剂条件下与氧气反应生成乙醛是氧化反应;⑧乙醇与乙酸反应生成乙酸乙酯是酯化反应,又叫取代反应。
(3)根据苯环、乙炔、乙烯、甲烷的结构来分析![]() 。
。
(4)戊烷分子式为C5H12,戊烷有3种同分异构体。
(1)①石油的分馏是利用各组分沸点不同分离,是物理变化,故①符合题意;②煤的干馏是隔绝空气加强热使之分解,是化学变化,故②符合题意;③石蜡的催化裂化是分子量大、沸点高的断裂为分子量小、沸点低的烃,是化学变化,故③不符合题意;④煤的气化是煤与水反应生成CO和氢气,是化学变化,故④不符合题意;⑤煤的液化是煤转变为液体燃料或物质,是化学变化,故⑤不符合题意;⑥煤焦油成分的分离是利用沸点不同进行分离,是物理变化,故⑥符合题意;因此下列变化属于物理变化的是①⑥;综上所述,答案为①⑥。
(2)有下列反应:①由乙烯制乙醇是加成反应;②甲烷在空气中燃烧是燃烧反应,也是氧化反应,③由氯乙烯制聚氯乙烯是加聚反应;④丙烯使溴水褪色是发生加成反应;⑤苯与浓硝酸、浓硫酸的混合在50℃—60℃条件下的反应生成硝基苯,是取代反应;⑥由乙烯制聚乙烯是加聚反应;⑦乙醇在铜作催化剂条件下与氧气反应生成乙醛是氧化反应;⑧乙醇与乙酸反应生成乙酸乙酯是酯化反应,又叫取代反应;因此其中属于取代反应的是⑤⑧,属于氧化反应的是②⑦,属于聚合反应的是③⑥,属于加成反应的是①④;故答案为:⑤⑧;②⑦;③⑥;①④。
(3)![]() ,前面四个碳原子在同一平面,后面七个碳原子在同一平面,中间碳碳三键在同一直线上,因此所有碳原子都可能在同一平面上,同一平面上的碳原子数最多为11个;故答案为11。
,前面四个碳原子在同一平面,后面七个碳原子在同一平面,中间碳碳三键在同一直线上,因此所有碳原子都可能在同一平面上,同一平面上的碳原子数最多为11个;故答案为11。
(4)戊烷分子式为C5H12。戊烷有3种同分异构体分别为CH3CH2CH2CH2CH3、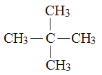 、
、![]() ;故答案为:CH3CH2CH2CH2CH3、
;故答案为:CH3CH2CH2CH2CH3、 、
、![]() 。
。


科目:高中化学 来源: 题型:
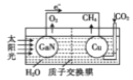
【题目】氮化镓(GaN)被称为第三代半导体材料,其应用取得了突破性的进展。一种镍催化法生产GaN的工艺如图:

(1)“热转化”时Ga转化为GaN的化学方程式是_____。
(2)“酸浸”的目的是_____,“操作Ⅰ”中包含的操作是_____。
某学校化学兴趣小组在实验室利用图装置模拟制备氮化镓:

(3)仪器X中的试剂是_____,仪器Y的名称是_____,装置G的作用是_____。
(4)加热前需先通入一段时间的H2,原因是_____。
(5)取某GaN样品m克溶于足量热NaOH溶液,发生反应 GaN+OH﹣+H2O![]() GaO2-+NH3↑,用H3BO2溶液将产生的NH3完全吸收,滴定吸收液时消耗浓度为c mol/L的盐酸V mL,则样品的纯度是_____。(已知:NH3+H3BO3=NH3H3BO3;NH3H3BO3+HCl=NH4Cl+H3BO3)
GaO2-+NH3↑,用H3BO2溶液将产生的NH3完全吸收,滴定吸收液时消耗浓度为c mol/L的盐酸V mL,则样品的纯度是_____。(已知:NH3+H3BO3=NH3H3BO3;NH3H3BO3+HCl=NH4Cl+H3BO3)
(6)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,成功地实现了用CO2和H2O合成CH4,请写出铜极的电极反应式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种国际上公认的安全无毒的绿色水处理剂。ClO2易爆炸,若用“惰性气体”等稀释时,爆炸性则大大降低。某化学小组用如图所示装置制备ClO2并处理废水。回答下列问题:
(1)仪器A的作用是__________,C装置的作用为__________。
(2)装置B中发生反应的离子方程式为______________________________。选用以上试剂制备ClO2的优点是______________________________。

(3)ClO2可与工业废水中CN-反应生成对大气无污染的气体,该反应中氧化剂和还原剂的物质的量之比为__________。
(4)有同学认为装置B反应后的溶液中可能存在Cl-,请设计实验验证。简要写出所需试剂、实验操作、现象和结论(已知AgClO3可溶于水)______________________________________。
(5)二氧化氯也可采用电解法生产:4ClO3-+2H2O![]() 4ClO2↑+O2↑+4OH-,写出电解过程中阴极反应方程式为__________________________________________。
4ClO2↑+O2↑+4OH-,写出电解过程中阴极反应方程式为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮料果醋中含有苹果酸,苹果酸经聚合生成聚苹果酸。已知:
a、0.1 mol苹果酸与足量NaHCO3溶液反应能产生4.48 L CO2(标准状况);
b、 苹果酸脱水生成能使溴水褪色的产物;
c、RCH2Br![]() RCH2COOH 。
RCH2COOH 。
d、RC≡CH+R’CHO![]() RC≡CCH-OH
RC≡CCH-OH
R’


请回答:
(1)写出B的结构简式____________________________________。
(2)写出苹果酸所含官能团的名称______, F转化成苹果酸可能发生的反应类型____。
(3)写出与苹果酸具有相同官能团的同分异构体的结构简式______________________。
(4)写出F与足量银氨溶液反应的化学方程式___________________________________。
(5)写出C与NaOH溶液反应的化学方程式_____________________________________。
(6)聚苹果酸具有良好的生物相容性,可作为手术缝合线等材料应用于生物医药和生物材料领域。其在生物体内水解的化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式中,正确的是( )
A.醋酸的电离方程式:CH3COOH → CH3COO一+ H+
B.常温下NH4Cl溶液的pH < 7
C.因为SO3的水溶液能够导电,所以SO3是强电解质
D.在常温下的NaOH溶液中,由于NaOH抑制了水的电离,水的离子积常数(KW)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成一种用于合成 γ 分泌调节剂的药物中间体,其合成的关键一步如图。下列有关化合物甲、乙的说法正确的是

A.甲→乙的反应为加成反应
B.甲分子中至少有 8 个碳原子在同一平面上
C.甲、乙均不能使溴水褪色
D.乙与足量 H2 完全加成的产物分子中含有 4 个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向20.00 mL 0.1000 mol·L1盐酸中滴加0.1000 mol·L1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图,已知lg3=0.5。下列说法不正确的是
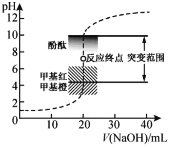
A.选择变色范围在pH突变范围内的指示剂,可减小实验误差
B.用移液管量取20.00 mL 0.1000 mol·L1盐酸时,移液管水洗后需用待取液润洗
C.NaOH标准溶液浓度的准确性直接影响分析结果的可靠性,因此需用邻苯二甲酸氢钾标定NaOH溶液的浓度,标定时采用甲基橙为指示剂
D.V(NaOH)=10.00 mL 时,pH约为1.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A.已知C(s,金刚石)=C(s,石墨) △H<0,则金刚石比石墨稳定
B.已知2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ·mol-1,则CO的燃烧热为566.0kJ·mol-1
C.已知C(s,石墨)+O2(g)=CO2(g) △H=akJ·mol-1,C(s,石墨)+![]() O2(g)=CO(g) △H=bkJ·mol-1,则a>b
O2(g)=CO(g) △H=bkJ·mol-1,则a>b
D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ·mol-1,则含lmolNaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物R的结构简式如图,下面有关说法不正确的是( )

A.1molR与足量的Na反应能生成1molH2
B.1molR最多能消耗2molNaOH
C.R能发生取代反应、加成反应、氧化反应、还原反应等反应类型
D.1molR完全燃烧消耗16molO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com