
����Ŀ��ClO2��һ�ֹ����Ϲ��ϵİ�ȫ������ɫˮ��������ClO2�ױ�ը��������������������ϡ��ʱ����ը�����͡�ij��ѧС������ͼ��ʾװ���Ʊ�ClO2��������ˮ���ش��������⣺
(1)����A��������__________��Cװ�õ�����Ϊ__________��
(2)װ��B�з�����Ӧ�����ӷ���ʽΪ______________________________��ѡ�������Լ��Ʊ�ClO2���ŵ���______________________________��

(3)ClO2���빤ҵ��ˮ��CN����Ӧ���ɶԴ�������Ⱦ�����壬�÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ__________��
(4)��ͬѧ��Ϊװ��B��Ӧ�����Һ�п��ܴ���Cl���������ʵ����֤����Ҫд�������Լ���ʵ�����������ͽ���(��֪AgClO3������ˮ)______________________________________��
(5)��������Ҳ�ɲ��õ�ⷨ������4ClO3����2H2O![]() 4ClO2����O2����4OH����д����������������Ӧ����ʽΪ__________________________________________��
4ClO2����O2����4OH����д����������������Ӧ����ʽΪ__________________________________________��
���𰸡����������Һ�����Ʋ���ĵμ�������Ʒ�Ӧ���� ��ȫƿ�������� H2C2O4 + 2ClO3�� + 2H+= 2CO2�� + 2ClO2�� + 2H2O ����ClO2��ͬʱ������CO2��CO2��ϡ��ClO2����ͱ�ը�Ŀ����� 1��1 ȡ����Bװ�÷�Ӧ�����Һ���Թ��У������������ᱵ��Һ������ַ�Ӧ���ã�ȡ�ϲ���Һ���Թ��У����������ữ����������Һ���۲��Ƿ��а�ɫ�������������У������Cl�������ޣ�����Cl���� ClO3��+e��= ClO2��+2OH��
��������
����װ��ͼ�ɵã�AΪ��Һ©����������Һ��Ϳ������٣�CΪ��ȫƿ����������Bװ��Ϊ�Ʊ�ClO2װ�ã������������������CO2��ClO2������������ԭ��ʧ�����غ�ɵ÷���ʽ��ClO2����CN������CO2��N2�����ݵ�ʧ�������������ͻ�ԭ�����ʵ���֮�ȣ�װ��B���������ʣ�࣬��Ҫ����Cl�������ȳ�ȥ����������ټ��飻���ʱ����������ԭ��Ӧ�������ܷ�Ӧ�ɵõ缫ʽ���ݴ˷�����
(1)����װ��ͼ��֪��AΪ��Һ©��������Ϊ���������Һ�����Ʋ���ĵμ�������Ʒ�Ӧ���ʣ�����Cװ�ý����ܡ������ܾ��϶̿�֪��CΪ��ȫƿ������������Ϊ�����������Һ�����Ʋ���ĵμ�������Ʒ�Ӧ���ʣ���ȫƿ����������
(2)Bװ��Ϊ�Ʊ�ClO2װ�ã������������������CO2��ClO2������������ԭ��ʧ�����غ�ɵ÷���ʽ��H2C2O4 + 2ClO3��+ 2H+= 2CO2�� + 2ClO2�� + 2H2O��ClO2�ױ�ը��������������������ϡ��ʱ����ը�����ͣ�����CO2Ϊ�����壬�����ŵ�������CO2��ϡ��ClO2����ͱ�ը�Ŀ����ԣ���Ϊ��H2C2O4 + 2ClO3��+ 2H+= 2CO2�� + 2ClO2�� + 2H2O������ClO2��ͬʱ������CO2��CO2��ϡ��ClO2����ͱ�ը�Ŀ����ԣ�
(3)ClO2���빤ҵ��ˮ��CN����Ӧ���ɶԴ�������Ⱦ�����壬������CO2��N2���÷�Ӧ����������ClO2������ԭΪCl����ÿĦ�����������ϼ۽���5�ۣ���ԭ����CN��,����������CO2��N2��ÿĦ����ԭ�����ϼ�����5�ۣ����ʵ���֮��Ϊ1��1����Ϊ��1��1��
(4)װ��B���������ʣ�࣬��Ҫ����Cl�������ȳ�ȥ����������ټ��飻��Ϊ��ȡ����Bװ�÷�Ӧ�����Һ���Թ��У������������ᱵ��Һ������ַ�Ӧ���ã�ȡ�ϲ���Һ���Թ��У����������ữ����������Һ���۲��Ƿ��а�ɫ�������������У������Cl�������ޣ�����Cl����
(5)���ʱ����������ԭ��Ӧ�������ܷ�Ӧ4ClO3����2H2O![]() 4ClO2����O2����4OH���õ缫ʽΪ��ClO3��+e��= ClO2��+2OH������Ϊ��ClO3��+e��= ClO2��+2OH����
4ClO2����O2����4OH���õ缫ʽΪ��ClO3��+e��= ClO2��+2OH������Ϊ��ClO3��+e��= ClO2��+2OH����


 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ����������������ԭ�����͵��ǣ�������
A.���Ƶ���ˮ�ڹ�������ɫ��dz
B.H2O2�м���MnO2������O2���ٶȼӿ�
C.�ϳɰ�Ϊ���NH3�IJ��ʣ�������Ӧ��ȡ��ѹ���µ�����
D.��ˮӦ�ܱձ��桢�����ڵ��´�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˾��Τ��һ�ָ�Ч����ѡ��������ø���Ƽ�����Ŀǰ�������е����ҩ��֮һ���ǹ��ϵĿ������С�����H1N1�Ȳ�������Ч��ҩ��֮һҲ�ǹ��ҵ�ս�Դ���ҩ�Ҳ��ר�ҳ���ʹ�ð�˾��Τ��Ϊ������״��������ҩ�����˵����ȷ���ǣ� ��

A.����ʹ���Ը��������Һ��ɫ
B.��˾��Τ���ڷ����廯����
C.����������̼ԭ�ӹ�ƽ��
D.���Է����ӳɷ�Ӧ���Ӿ۷�Ӧ��������Ӧ��ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йز����ݻ��������˵����ȷ����
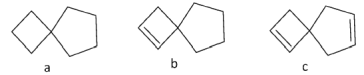
A.���ֻ�������c�е�����̼ԭ��һ������
B.b��c������ʹ��ˮ���������Һ��ɫ������ɫ��ԭ����ͬ
C.b����ϩ��Ϊͬϵ��
D.a�Ķ��ȴ��ﳬ��9�ֽṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����0.100 mol/L������Һ�ζ�25.00 mL 0.100 mol/L�İ�ˮ��Һ���ζ�������ͼ��ʾ�������й�˵������ȷ����

A.���ü���ָʾ��
B.a����ʾ��Һ�У�c(NH4��)>c(NH3��H2O)>c(Cl��)>c(OH��)>c(H��)
C.ˮ�ĵ���̶�b����ʾ��Һ����a����ʾ��Һ
D.c����ʾ��Һ�У�c(Cl��)��2c(OH��)��2c(H��)��2c(NH3��H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A.������̼������Һ��Ӧ��2H++CO32���TCO2��+H2O
B.������Һ������������ͭ��Ӧ��CH3COOH+OH���TCH3COO��+H2O
C.��������Һ��ͨ������������̼��C6H5O��+CO2+H2O��C6H5OH+CO32��
D.��ȩ��Һ��������������Һ����HCHO+4[Ag��NH3��2]++4OH��![]() CO32��+2NH4++4Ag��+6NH3+2H2O
CO32��+2NH4++4Ag��+6NH3+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܻ���DBP���ڱ����������������ҪӦ����PVC�Ⱥϳɲ�����������������Ӧԭ��Ϊ��

ʵ�鲽�����£�
����1��������ƿ�з���14.8g�ڱ�����������25mL��������4��Ũ���ᣬ����������b����Ӧװ����ͼ����
����2�������������ڱ���������������ʧ�����������ڡ�
����3����������һ���̶�ʱ��������150��
����4����ȴ��������ƿ�е�Һ�嵹���©���У��ñ���ʳ��ˮ��5%̼����ϴ�ӡ�
����5����ѹ�����ռ�200~210��2666Pa��֣�����DBP��Ʒ
��1��Ũ���������______________________��������������______________________��
��2����Ӧ������������������Ŀ����___________________________________________��

��3��ͼ������a�������Ƿ�ˮ�����Է�������������_____________________________��
����3��ȷ���д��������ɵ�������_______________________________________��
��4��̼������Һϴ�ӵ�Ŀ����_________________________________________________��
�ü�ѹ�����Ŀ����_____________________________________________________��
��5��д����������135�������ѵķ�Ӧ����ʽ___________________________________��
д��DBP������������Һ��ˮ��ķ���ʽ_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ������Ҫ����Դ�ͱ������Դ,���ǵ��¡�ʳ��ס���С��úܴ�̶���ֱ�ӻ�����ʯ�Ͳ�Ʒ�йء����ϡ��ϳ����ϳ���ά����ϳɲ��ϣ����ֿ�ʯ����������ʯ�ͱ��뾭�����Ʋ���ʹ�ã�ʯ�͵�������Ҫ�з����ѻ������������Ƶȡ�
ú����һ�ֿ���ȼ�ϣ�Ҳ�DZ������Դ���������л������������ɵĸ��ӵĻ���ú���ۺ�������ú��������ú�ĸ���ú��Һ���ȡ�
��ú���������ù���ú��һ���¶ȼ�ѹǿ�������������������������������ȣ�����һϵ�л�ѧ��Ӧ��ʹú�е��л���ת��Ϊ�����������һ����̼����̬���ʵĹ��̡���ú�ĸ����ǰ�ú����������ǿ��ʹ���ֽ�Ĺ��̡�úͨ�����������̿��ú���͡��ְ�ˮ�ͽ�¯���ȣ�����ú���Ϳ���ͨ�������Ƶ���Ҫ�Ļ���ԭ�ϡ���ú��Һ���ǰ�úĥ�ɷ�ĩ���һЩȼ���ͻ�ϣ��ڴ��������¼��⣬�õ���Һ������Ĺ��̡���Һ������Ҳ������ʯ�͡�
�Ķ��������֣������ѧ֪ʶ���ش��������⣺
(1)���б仯���������仯����________________________
��ʯ�͵ķ���ú�ĸ���ʯ���Ĵ��ѻ�����ú����������ú��Һ������ú���ͳɷֵķ��롣
(2)�����з�Ӧ��������ϩ���Ҵ� �ڼ����ڿ�����ȼ�� ��������ϩ�ƾ�����ϩ �ܱ�ϩʹ��ˮ��ɫ �ݱ���Ũ���ᡢŨ����Ļ����50����60�������µķ�Ӧ ������ϩ�ƾ���ϩ ���Ҵ���ͭ��������������������Ӧ������ȩ ���Ҵ������ᷴӦ��������������
��������ȡ����Ӧ���ǣ�����ţ���ͬ��_______������������Ӧ����________�����ھۺϷ�Ӧ����_______�����ڼӳɷ�Ӧ����_______��
(3)![]() ���ӽṹ����ͬһƽ���ϵ�̼ԭ�������Ϊ______����
���ӽṹ����ͬһƽ���ϵ�̼ԭ�������Ϊ______����
(4)ʯ�ͷ����Ʒ֮һ�������к������飬�������ʽΪC5H12��д�����������ͬ���칹��_____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С���ð����ȡ̼���Ƶ�ԭ������ʵ�����������ģ��װ���Ʊ�NaHCO3������̨��Cװ��ˮԡ�е��¶ȼơ��ƾ��Ƶ���ȥ����Ȼ������ȡNa2CO3���ṩ���Լ��У����ᡢ���ᡢʯ��ʯ��Ũ��ˮ��̼�������Һ��ˮ����ʯ�ҡ�ʳ�εȡ�
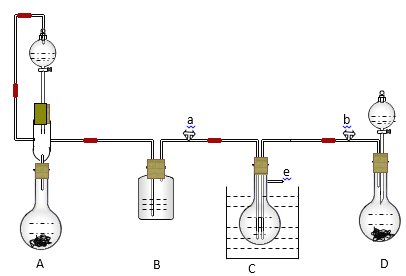
(1)��A�з�Һ©������ƿ�м�����Լ��ֱ���________��_________��D�з�Һ©������ƿ�м�����Լ��ֱ�Ϊ______��________��
(2) B�м�����Լ���______________, ������________________________________��
(3)д��C�����ɵ�NaHCO3��ѧ����ʽ��____________________________________________��
(4)װ��A�з�Һ©���Ϸ�װһ���ܵ���Ҫ������____________________________________��
(5)ʵ�鿪ʼa��b����������ȷ����Ӧ�ǣ�ѡ����ţ�_______��
��ͬʱ��a��b������ ���ȴ�a�����b ���ȴ�b�����a
(6)����Cװ����Һ�����ɵ�������NaHCO3������Na2CO3�ķ�����____________________��
(7)��C��NaHCO3����ȡNa2CO3����е�ʵ������й��ˡ�ϴ�ӡ�_____��
(8)����ɫ��ѧ�Ƕȿ�����һװ�õ���Ҫȱ����β���ݳ����˷���Դ���Ľ��ķ�����___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com