
【题目】塑化剂DBP(邻苯二甲酸二丁酯)主要应用于PVC等合成材料中作软化剂。反应原理为:

实验步骤如下:
步骤1:在三颈瓶中放入14.8g邻苯二甲酸酐、25mL正丁醇、4滴浓硫酸,开动搅拌器b(反应装置如图)。
步骤2:缓缓加热至邻苯二甲酸酐固体消失,升温至沸腾。
步骤3:等酯化到一定程度时,升温至150℃
步骤4:冷却,将三颈瓶中的液体倒入分漏斗中,用饱和食盐水和5%碳酸钠洗涤。
步骤5:减压蒸馏,收集200~210℃2666Pa馏分,即得DBP产品
(1)浓硫酸的作用______________________,搅拌器的作用______________________。
(2)反应过程中正丁醇过量的目的是___________________________________________。

(3)图中仪器a的名称是分水器,试分析它的作用是_____________________________。
步骤3中确定有大量酯生成的依据是_______________________________________。
(4)碳酸钠溶液洗涤的目的是_________________________________________________。
用减压蒸馏的目的是_____________________________________________________。
(5)写出正丁醇在135℃生成醚的反应方程式___________________________________。
写出DBP在氢氧化钠溶液中水解的方程式_______________________________。
【答案】催化剂、脱水剂 使反应物充分混合 增大正丁醇的含量,可促使反应正向移动,增大邻苯二甲酸酐的转化率 及时分离出酯化反应生成的水,促使反应正向移动 分水器中有大量的水生成 用碳酸钠除去酯中的醇和酸 减压蒸馏可降低有机物的沸点,可以防止有机物脱水碳化,提高产物的纯度 2CH3(CH2)2CH2OH![]() = CH3(CH2)3O(CH2)3CH3+H2O
= CH3(CH2)3O(CH2)3CH3+H2O 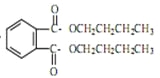 +2NaOH
+2NaOH![]() 2CH3(CH2)2CH2OH+2H2O+
2CH3(CH2)2CH2OH+2H2O+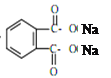
【解析】
(1)塑化剂DBP(邻苯二甲酸二丁酯),为邻苯二甲酸酐与CH3CH2CH2CH2OH发生酯化反应生成,浓硫酸在该反应中起催化剂、脱水剂,搅拌器的作用为使反应物充分混合;
(2)生成邻苯二甲酸二丁酯为可逆反应,增加反应物正丁醇的量可促使反应正向移动,提高另一反应物的转化率;
(3)分水器分离出生成的水,有利于平衡向生成邻苯二甲酸二丁酯的方向移动,同时可通过大量水判断有大量酯生成;
(4)饱和Na2CO3溶液可溶解正丁醇,中和酸,从而除去产品中的杂质;减压蒸馏可降低有机物的沸点,用减压蒸馏可以防止有机物脱水碳化,提高产物的纯度;
(5)正丁醇在135℃发生分子间脱水生成醚,DBP在氢氧化钠溶液中水解生成邻苯二甲酸钠和正丁醇。
(1)塑化剂DBP(邻苯二甲酸二丁酯),为CH3CH2CH2CH2OH与邻苯二甲酸酐发生的酯化反应,酯化反应的本质为酸脱羟基、醇脱氢,所以浓硫酸在该反应中作催化剂、脱水剂,为使反应物充分混合而反应,应用搅拌器搅拌;
故答案为:催化剂、脱水剂;使反应物充分混合;
(2)邻苯二甲酸酐、25mL正丁醇、4滴浓硫酸,发生酯化反应生成邻苯二甲酸二丁酯,该反应为可逆反应,增加反应物正丁醇的量可促使反应正向移动,提高另一反应物邻苯二甲酸酐的转化率;
故答案为:增大正丁醇的含量,可促使反应正向移动,增大邻苯二甲酸酐的转化率;
(3)在生成邻苯二甲酸二丁酯的同时生成水,属于可逆反应,a为分水器,可起到冷凝的作用,及时分离出酯化反应生成的水,促使反应正向移动,提高反应产率,确定有大量酯生成的依据是分水器中有大量的水生成;
故答案为:及时分离出酯化反应生成的水,促使反应正向移动;分水器中有大量水生成;
(4)得到酯中含有挥发出的邻苯二甲酸、正丁醇,饱和Na2CO3溶液可溶解正丁醇,中和酸,从而除去产品中的杂质,减压蒸馏可降低有机物的沸点,可以防止有机物脱水碳化,提高产物的纯度;
故答案为:用碳酸钠除去酯中的醇和酸;可以防止有机物脱水碳化,提高产物的纯度;
(5)正丁醇在135℃发生分子间脱水,两分子生成一分子醚,反应为:2CH3(CH2)2CH2OH![]() = CH3(CH2)3O(CH2)3CH3+H2O;DBP在氢氧化钠溶液中水解的方程式为
= CH3(CH2)3O(CH2)3CH3+H2O;DBP在氢氧化钠溶液中水解的方程式为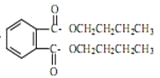 +2NaOH
+2NaOH![]() 2CH3(CH2)2CH2OH+2H2O+
2CH3(CH2)2CH2OH+2H2O+ 。
。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】合成具有良好生物降解性的有机高分子材料是有机化学研究的重要课题之一。聚醋酸乙烯酯(PVAc)水解生成的聚乙烯醇(PVA),具有良好生物降解性,常用于生产安全玻璃夹层材料PVB。有关合成路线如图(部份反应条件和产物略去)。
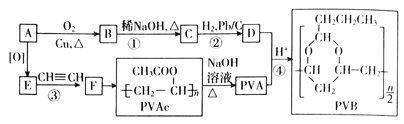
已知:I.A为饱和一元醇,其中氧的质量分数约为34.8%;
II.![]()
![]() ;
;
III.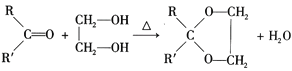 (R、R’可表示烃基或氢原子)
(R、R’可表示烃基或氢原子)
请回答:
(1)C中官能团的名称为_____________,写出C的反式异构体的结构简式:_______________,该分子中最多有______________个原子共面
(2)D与苯甲醛反应的化学方程式为_________________________________________________。
(3)③的反应类型是_________________________
(4)写出两种与F具有相同官能团的同分异构体的结构简式_____________________________。
(5)参照上述信息,设计合成路线,以溴乙烷为原料(其他无机试剂任选)合成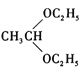 ,_____________
,_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
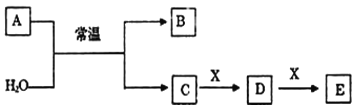
(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:___。
(2)若A为淡黄色粉末,X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种稀溶液,可选择的试剂为___(填代号)。
A.盐酸 B.BaCl2溶液 C.Ca(OH)2溶液
(3)若A为非金属氧化物,B为气体,遇空气会变红棕色,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种国际上公认的安全无毒的绿色水处理剂。ClO2易爆炸,若用“惰性气体”等稀释时,爆炸性则大大降低。某化学小组用如图所示装置制备ClO2并处理废水。回答下列问题:
(1)仪器A的作用是__________,C装置的作用为__________。
(2)装置B中发生反应的离子方程式为______________________________。选用以上试剂制备ClO2的优点是______________________________。

(3)ClO2可与工业废水中CN-反应生成对大气无污染的气体,该反应中氧化剂和还原剂的物质的量之比为__________。
(4)有同学认为装置B反应后的溶液中可能存在Cl-,请设计实验验证。简要写出所需试剂、实验操作、现象和结论(已知AgClO3可溶于水)______________________________________。
(5)二氧化氯也可采用电解法生产:4ClO3-+2H2O![]() 4ClO2↑+O2↑+4OH-,写出电解过程中阴极反应方程式为__________________________________________。
4ClO2↑+O2↑+4OH-,写出电解过程中阴极反应方程式为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸是合成阿斯匹林的重要原料。水杨酸的结构简式为![]()
请回答下列问题:
(1)请写出水杨酸中除苯环外具有的官能团的名称______________________;
(2)请写出与水杨酸互为同分异构体,既属于酚类又属于酯类化合物的结构简式:____________________________________________________;
(3)写出水杨酸与碳酸氢钠反应的化学方程式:______________________
(4)在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林如下图所示,1摩尔阿司匹林与氢氧化钠完全反应需要氢氧化钠_____摩尔。
![]()
(5)阿斯匹林药片需要保存在干燥处,受潮的药片易变质不宜服用;检验受潮药片是否变质的试剂是(只选一种试剂即可)_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮料果醋中含有苹果酸,苹果酸经聚合生成聚苹果酸。已知:
a、0.1 mol苹果酸与足量NaHCO3溶液反应能产生4.48 L CO2(标准状况);
b、 苹果酸脱水生成能使溴水褪色的产物;
c、RCH2Br![]() RCH2COOH 。
RCH2COOH 。
d、RC≡CH+R’CHO![]() RC≡CCH-OH
RC≡CCH-OH
R’


请回答:
(1)写出B的结构简式____________________________________。
(2)写出苹果酸所含官能团的名称______, F转化成苹果酸可能发生的反应类型____。
(3)写出与苹果酸具有相同官能团的同分异构体的结构简式______________________。
(4)写出F与足量银氨溶液反应的化学方程式___________________________________。
(5)写出C与NaOH溶液反应的化学方程式_____________________________________。
(6)聚苹果酸具有良好的生物相容性,可作为手术缝合线等材料应用于生物医药和生物材料领域。其在生物体内水解的化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式中,正确的是( )
A.醋酸的电离方程式:CH3COOH → CH3COO一+ H+
B.常温下NH4Cl溶液的pH < 7
C.因为SO3的水溶液能够导电,所以SO3是强电解质
D.在常温下的NaOH溶液中,由于NaOH抑制了水的电离,水的离子积常数(KW)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向20.00 mL 0.1000 mol·L1盐酸中滴加0.1000 mol·L1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图,已知lg3=0.5。下列说法不正确的是
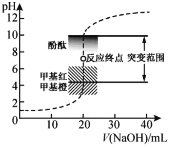
A.选择变色范围在pH突变范围内的指示剂,可减小实验误差
B.用移液管量取20.00 mL 0.1000 mol·L1盐酸时,移液管水洗后需用待取液润洗
C.NaOH标准溶液浓度的准确性直接影响分析结果的可靠性,因此需用邻苯二甲酸氢钾标定NaOH溶液的浓度,标定时采用甲基橙为指示剂
D.V(NaOH)=10.00 mL 时,pH约为1.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室从海带中提取碘,设计实验流程如下:
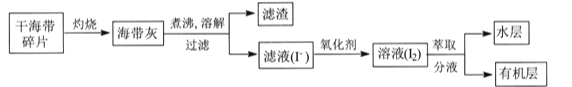
下列说法错误的是
A.过滤操作主要除去海带灰中难溶于水的固体,它们主要是无机物
B.氧化剂参加反应的离子方程式为2I-+H2O2+2H+=I2+2H2O
C.萃取过程所用有机溶剂可以是酒精或四氯化碳
D.因I2易升华,I2的有机溶液难以通过蒸馏法彻底分离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com