
以白云石(化学式表示为MgCO3·CaCO3)为原料制备Mg(OH)2的工艺流程如下图所示。

(1)研磨的作用是 。
(2)该工艺中可循环使用的物质是 、 (写化学式)。
(3)白云石轻烧的主要产物是MgO·CaCO3,而传统工艺是将白云石加热分解为MgO和CaO后提取,白云石轻烧的优点是 。
(4)加热反应的离子方程式为 。
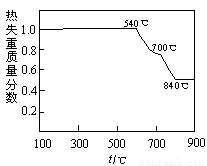
(5)①加热反应时,在323k和353k溶液中c(NH4+)与反应时间的关系如下图所示,请在下图画出373k的曲线。

②由图可知,随着温度升高: 。
(16分)
(1)增大固体的表面积,加快反应速率,增大原料利用率(2分)
(2)NH3、(NH4)2SO4(各2分)
(3)减少能耗、减少CO2的排放等(即节能、低碳)(2分)
(4)MgO + 2NH4+  Mg2+
+ 2NH3↑ + H2O(3分,写成等号不扣分)
Mg2+
+ 2NH3↑ + H2O(3分,写成等号不扣分)
(5)①(3分) ②反应的时间缩短、平衡时c(NH4+)减小(合理也给分)(2分)

【解析】
试题分析:(1)研磨的作用主要从对反应速率和原料的利用率角度分析,可以增大固体的表面积,加快反应速率,增大原料利用率;(2)图中加热反应时放出氨气,而沉淀反应时加入氨水,因此可以将氨气循环利用,图中研磨时需要加入硫酸铵和水,而过滤时得到的溶液中含有硫酸铵,因此可以将硫酸铵循环利用;(3)依题意,轻烧时只有碳酸镁分解,而碳酸钙不分解,由于二者的分解反应都是吸热反应,因此可以减少能耗、减少CO2的排放等(即节能、低碳);(4)加热反应的反应物为轻烧产生的氧化镁、研磨时加入的硫酸铵溶液,生成物是氨气,由此推断加热时溶液中发生复分解反应,根据电解质拆分原则、电荷和原子守恒原理,则该反应为MgO+2NH4+ Mg2++2NH3↑+H2O;(5)读图可知,随着温度的升高,反应速率加快,平衡向正反应方向移动,则达到平衡的时间缩短,平衡时铵根离子浓度减小,由此可以确定373K时曲线的起点、平衡点或拐点,从而可以画出曲线。
Mg2++2NH3↑+H2O;(5)读图可知,随着温度的升高,反应速率加快,平衡向正反应方向移动,则达到平衡的时间缩短,平衡时铵根离子浓度减小,由此可以确定373K时曲线的起点、平衡点或拐点,从而可以画出曲线。
考点:考查物质制备化学工艺流程,涉及研磨的作用、可以循环使用的物质、评价改进工艺的优点、关键步骤的离子方程式、温度对反应速率和平衡移动的影响规律及画出相应的图像等。


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 自然界存在着一种白云石的矿石,其化学式是xCaCO3?yMgCO3.以它为原料,可制取耐火材料等.
自然界存在着一种白云石的矿石,其化学式是xCaCO3?yMgCO3.以它为原料,可制取耐火材料等.| 高温 |
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省汕头市高三上学期期末考试理综化学试卷(解析版) 题型:填空题
以白云石(化学式表示为MgCO3·CaCO3)为原料制备氢氧化镁的工艺流程如下:

(1)根据流程图判断白云石“轻烧”后固体产物的主要成份 _____ 。则“轻烧”温度应不超过 _____ 。
(2)流程图中“加热反应”的化学方程式为 _ _________________________ 。
(3)沉淀过程溶液的pH=9.5,此时溶液中c(Mg2+)= _______ (已知Ksp[Mg(OH)2]=5.61×10-12)。
(4)该工艺中可以循环使用的物质是 、 (填化学式)。
(5)传统工艺将白云石分解为氧化镁和氧化钙后提取,该工艺采用轻烧白云石 的方法,其优点是 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
以白云石(化学式表示为MgCO3·CaCO3)为原料制备Mg(OH)2的工艺流程如下图所示。
(1)研磨的作用是 _ 。过滤所用的玻璃仪器是烧杯 _ 、 _ 。
(2)该工艺中可循环使用的物质是 _ 、 _ (写化学式)。
(3)白云石轻烧的主要产物是MgO·CaCO3,而传统工艺是将白云石加热分解为MgO和CaO后提取,白云石轻烧的优点是 _ 。
(4)加热反应的离子方程式为 _ 。
 (5)①加热反应时,在323k和353k溶液中c(NH4+)与反应时间的关系如下图所示,请在下图画出373k的曲线。
(5)①加热反应时,在323k和353k溶液中c(NH4+)与反应时间的关系如下图所示,请在下图画出373k的曲线。
②由图可知,随着温度升高: _ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com