
| A、电解稀硫酸溶液,溶液的浓度会逐渐变大,pH逐渐变大 |
| B、氯碱工业中,电路中每转移1mol电子,理论上收集到1mol气体 |
| C、向电解氯化钠溶液所得的稀溶液中,加入浓盐酸,能恢复到原溶液浓度 |
| D、粗铜精炼时,粗铜应作电解池的阳极,电解质溶液在电解过程中浓度不变 |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
| 催化剂 |
| 催化剂 |
| 温度CO2% n(H2)/n(CO2) | 500K | 600K | 700K | 800K |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
| n(H2) |
| n(CO2) |
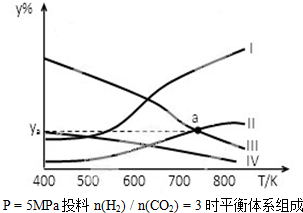 ①表示CH3CH2OH体积分数曲线的是
①表示CH3CH2OH体积分数曲线的是查看答案和解析>>
科目:高中化学 来源: 题型:

| A、因为锌与硫酸锌,铜与硫酸铜不反应,所以该装置无法工作 |
| B、电池反应为:Zn2++Cu═Zn+Cu2+ |
| C、盐桥中的Cl-移向ZnSO4溶液 |
| D、在外电路中,电流从负极流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 称量25.0g氯化钠固体 |
B、 收集NO2气体(尾气处理装置略) |
C、 检验出此装置漏气 |
D、 吸收NH3不会造成倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2S溶液中:SO42-、K+、ClO-、Cu2+ |
| B、新制氯水中:Cl-、NO3-、Na+、SO32- |
| C、0.1 mol?L-1的NaOH溶液中:K+、Na+、SO42-、CO32- |
| D、由水电离出的c(OH-)=1×10-11 mol/L的溶液中:K+、Al3+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫使溴水褪色 SO2+Br2+2H2O=4H++SO42-+2Br- |
| B、用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) CO32-+2H+=CO2↑+H2O |
| C、硫酸铜与Ba(OH)2溶液反应 Cu2++2OH-=Cu(OH)2↓ |
| D、少量CO2通入Na2SiO3溶液:CO2+SiO32-+H2O=CO32-+H2SiO3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com