
| A、二氧化硫使溴水褪色 SO2+Br2+2H2O=4H++SO42-+2Br- |
| B、用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) CO32-+2H+=CO2↑+H2O |
| C、硫酸铜与Ba(OH)2溶液反应 Cu2++2OH-=Cu(OH)2↓ |
| D、少量CO2通入Na2SiO3溶液:CO2+SiO32-+H2O=CO32-+H2SiO3↓ |


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
A、 如图装置可测定反应速率 |
B、 用如图装置制备Fe(OH)2 |
C、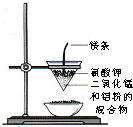 用如图装置制取少量金属锰 |
D、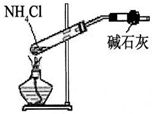 实验室用如图所示装置制取少量氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解稀硫酸溶液,溶液的浓度会逐渐变大,pH逐渐变大 |
| B、氯碱工业中,电路中每转移1mol电子,理论上收集到1mol气体 |
| C、向电解氯化钠溶液所得的稀溶液中,加入浓盐酸,能恢复到原溶液浓度 |
| D、粗铜精炼时,粗铜应作电解池的阳极,电解质溶液在电解过程中浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 则△H2
则△H2查看答案和解析>>
科目:高中化学 来源: 题型:
| ①H2SO4溶液中H2SO4 | ①H2SO4溶液中HSO4- | ②NaHSO4溶液中HSO4- | ③CH3COOH 溶液 |
④HCl溶液 |
| 100% | 10% | 29% | 1.3% | 100% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、①③④ |
| C、①③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,说明结合H+的能力:AlO2->CO32- |
| B、将SO2通入酸性高锰钾溶液中,溶液褪色,不能说明SO2具有漂白性 |
| C、高温时碳能置换出二氧化硅中的硅,说明还原性碳比硅强 |
| D、亚硫酸是良好的还原剂,浓H2SO4是良好的氧化剂,但两者混合,却不发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com