
����Ŀ����ͼ��ʾ��ijʵ��С�����Ȼ�����Һ������̪����װ�á��ж������ռ���װ��ʡ��û�л��������缫����ʯī�缫��
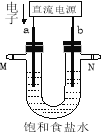
��1��a�缫������ ��
��2����������a������۲쵽������ ��
��3�������ܷ�Ӧ���ӷ���ʽΪ ��
��4��ijʵ��С����1.6A�������6.02min���������������� mL����״�������壨һ�����ӵĵ���Ϊ 1.6��10-19C����
��5������b�缫���������缫�����һ��ʱ���U�ܵײ����ֺ��ɫ���������û�ѧ����ʽ������һ����д���ܷ�Ӧ�Ļ�ѧ����ʽ ��
���𰸡���1��������
��2��a���������ݲ�������Һ��ɺ�ɫ
��3��2Cl��+2H2O ![]() Cl2��+H2��+2OH��
Cl2��+H2��+2OH��
��4��67.2
��5��4Fe+10H2O+O2![]() 4Fe(OH)3+4H2��
4Fe(OH)3+4H2��
��������
�����������1�����ݵ�����������a���Ǹ���������b��������������a��������b��������
�ʴ�Ϊ��������
��2������Ȼ�����Һʱ�������������ӵõ�������������2H2O+2e-=H2��+2OH-��ͬʱ���������������������ӣ����������ʼ��ԣ������̪����Һ�ʺ�ɫ��
�ʴ�Ϊ�� a������Һ��ɺ�ɫ��
��3��ͨ�����Ϸ���֪����Ӧ�����Ȼ��ƺ�ˮ���������������������������������ԣ��ܷ�Ӧ�����ӷ���ʽΪ��2Cl-+2H2O![]() Cl2��+H2��+2OH-��
Cl2��+H2��+2OH-��
�ʴ�Ϊ��2Cl-+2H2O![]() Cl2��+H2��+2OH-��
Cl2��+H2��+2OH-��
��4��������ͨ���ĵ����ΪQ=It=1.6��6.02��60C��
ͨ���ĵ�����Ϊn=![]() =
=![]() =6.02��60��1019��=6.0��10-3mol������H2O+2e-=H2��+2OH-��֪��ʱ��������3.0��10-3mol��V(H2)= n(H2)Vm=3.0��10-3mol��22.4L/mol��103mL/L=67.2mL��
=6.02��60��1019��=6.0��10-3mol������H2O+2e-=H2��+2OH-��֪��ʱ��������3.0��10-3mol��V(H2)= n(H2)Vm=3.0��10-3mol��22.4L/mol��103mL/L=67.2mL��
�ʴ�Ϊ��67.2mL��
��5������b�缫���������缫�����Һ��ΪNaCl��Һ��b�缫����ʧ���ӷ���������Ӧ���缫��ӦʽΪFe-2e-=Fe2+�����������������������ӣ��������Ӻ���������������Fe(OH)2��ɫ������Fe(OH)2���������ɺ��ɫ��Fe(OH)3���÷�Ӧ���̵��ܷ�Ӧ��ѧ����ʽΪ4Fe+10H2O+O2![]() 4Fe(OH)3+4H2����
4Fe(OH)3+4H2����
�ʴ�Ϊ��4Fe+10H2O+O2![]() 4Fe(OH)3+4H2����
4Fe(OH)3+4H2����


 ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��![]() H��
H��![]() H����O2��O3���������飨CH3CH2 CH2 CH3�����춡��
H����O2��O3���������飨CH3CH2 CH2 CH3�����춡��![]() �������飨CH4������飨C3H8����
�������飨CH4������飨C3H8����
��1����Ϊͬλ�ص���______ ������ţ���ͬ����
��2����Ϊͬϵ�����______��
��3����Ϊͬ���칹�����______��
��4����Ϊͬ�����������______��
II.A��E�ȼ��������ӵ����ģ������ͼ��ʾ���ݴ˻ش��������⡣
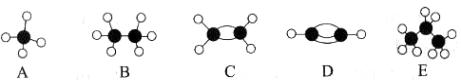
��1��D�ĵ���ʽΪ___________��A�Ķ���ȡ������ �֡�
��2������Ϊֲ���������ڼ����� ����ṹ��ʽ����
��3��A��������Ӧ�������ɶ������ʣ�����д����һ����Ӧ�Ļ�ѧ����ʽ�� ��
��4��C��ˮ��һ�������·�Ӧ�Ļ�ѧ����ʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ�ܱ�FeCl3��Ũ��Һ��ʴ���仯ѧ����ʽ�ǣ�Cu��2FeCl3=CuCl2��2FeCl2��
�ֽ���ͭ��ӡˢ��·�����120mL FeCl3����Һ�У���9.6 gͭ����ʴ����ȡ��ӡˢ��·�壬����Һ�м���8.4g���ۣ�����ַ�Ӧ����Һ�л�����4.8g�����������Һ������䣬�Ҳ����ǽ�������ˮ������
��1������9.6gͭ����ʴ�������Һ�л���4.8g�����˵����Һ�п϶�����_____������4.8g���岻������____����4.8g��_______��
��2��9.6 gͭ����ʴ����________ mol Fe2����
��3�������Һ�н����������ʵ���Ũ��c��Cu2������______��c��Fe2������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ָ�������£�һ���ܴ����������( )
A. ��ʹ��ɫʯ����ֽ���ɫ����Һ�У�K����Na����CO32-��NO3-
B. c(H��)��1��10��1mol/L����Һ�У�Cu2����Al3����SO42-��NO3-
C. ��ʹ�⻯�ص�����ֽ��������Һ�У�Na����NH4+��S2����Br��
D. ˮ�������c(H��)��1��10��12mol/L����Һ�У�Na����Mg2����Cl����SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������ϢϢ��أ�����˵���������
A. ����ˮ���γɵ�Al(OH)3����������ˮ�������������ˮ�ľ���
B. ˮ���������������ϼ��ͷ����
C. ú�ĸ����ʯ�͵ķ�����������仯
D. Ư�۳��ڱ�¶�ڿ����л����ʧЧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
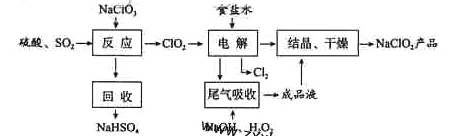
����Ŀ��NaClO2��һ����Ҫ��ɱ����������Ҳ������Ư��֯��ȣ���һ�������������£�
�ش��������⣺
(1)NaClO2��Cl�Ļ��ϼ�Ϊ_______��
(2)д������Ӧ������������ClO2�Ļ�ѧ����ʽ ��
(3)����⡱����ʳ��ˮ�ɴ���ˮ���ƶ��ɣ�����ʱ��Ϊ��ȥMg2+��Ca2+��Ҫ������Լ��ֱ�Ϊ________��________������⡱��������Ӧ����Ҫ������______��
(4)��β�����ա������ա���⡱�����ų�������ClO2�������շ�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ________���÷�Ӧ������������_________��
(5)����Ч�Ⱥ��������������������������������������䶨���ǣ�ÿ�˺��������������������൱�ڶ��ٿ�Cl2������������NaClO2����Ч�Ⱥ���Ϊ____��(������������λС��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ν�Ͻ𣬾��Dz�ͬ�ֽ���(Ҳ����һЩ�ǽ���)���ۻ�״̬���γɵ�һ���ۺ���±�Ϊ���ֽ������ۡ��е㣺
Na | Cu | Al | Fe | |
�۵�(��) | 97.5 | 1083 | 660 | 1535 |
�е�(��) | 883 | 2595 | 2200 | 3000 |
�������������ж����в����γɺϽ����( )
A��Cu��Al B��Fe��Cu C��Fe��Na D��Al��Na
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ����٤������������˵����ȷ���ǣ� ��
A��7.8gNa2O2�к��е���������ĿΪ0.2NA
B��1mol����ϩ�к��е�̼̼˫����Ϊ4NA
C��1molNaCl�������NA��Na+
D��28g��ϩ�����к��м��Թ��ۼ�����ĿΪ6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na2O2��HCl��Al2O3����������ˮ����ȫ��Ӧ����Һ��ֻ����Na����H����Cl����OH��������Һ�����ԣ���Na2O2��HCl��Al2O3�����ʵ���֮�ȿ���Ϊ(����)
A��3��2��1 B��2��4��1
C��2��3��1 D��4��2��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com