
分析 (1)FeCl3具有氧化性,可与铜发生氧化还原反应,以此解答;
(2)二氧化硅与HF反应生成四氟化硅和水;
(3)NO2与水反应制取HNO3的方程式为3NO2+H2O=2HNO3+NO,该反应中N元素化合价由+4价变为+2价、+5价,以此解答该题.
解答 解:(1)FeCl3具有氧化性,可与铜发生氧化还原反应生成CuCl2和FeCl2,反应的化学方程式为Cu+2FeCl3═2FeCl2+CuCl2,
故答案为:Cu+2FeCl3═2FeCl2+CuCl2;
(2)二氧化硅与HF反应生成四氟化硅和水,其反应的方程式为:SiO2+4HF=SiF4↑+2H2O;
故答案为:SiO2+4HF=SiF4↑+2H2O;
(3)NO2与水反应制取HNO3的方程式为3NO2+H2O=2HNO3+NO,该反应中N元素化合价由+4价变为+2价、+5价,化合价降低的二氧化氮是氧化剂、化合价升高的二氧化氮是还原剂,所以二氧化氮既是氧化剂又是还原剂,
故答案为:3NO2+H2O=2HNO3+NO;NO2;NO2.
点评 本题考查元素化合物知识、氧化还原反应,本题注意氯化铁的强氧化性的性质,学习中注意积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 6种 | C. | 8种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
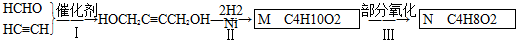
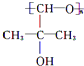

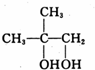 ,B中的官能团名称是醛基和醇羟基.
,B中的官能团名称是醛基和醇羟基.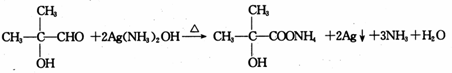 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl中含有杂质Na2SO4(适量氯化钡) | |
| B. | FeSO4 中含有杂质CuSO4(铁粉) | |
| C. | SO2中含有少量HCl气体(氢氧化钠溶液) | |
| D. | CO2中含有少量的CO(灼热的氧化铜) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2gD2O中含有的电子总数为NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 1mol K与足量O2反应,生成K2O、K2O2和KO2的混合物时转移的电子数为NA | |
| D. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为10-13NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | |
| C | D |
| 化学键 | H-H | Br-Br | H-Br |
| 键能(kJ/mol) | 436 | 194 | 362 |
| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com