
| A | B | |
| C | D |
| 化学键 | H-H | Br-Br | H-Br |
| 键能(kJ/mol) | 436 | 194 | 362 |
| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
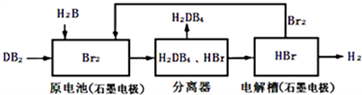
分析 由短周期元素A、B、C、D在周期表中的位置,可知A、B处于第二周期,C、D处于第三周期,B、D同主族,二者最外层电子数之和为12,则B为O元素、D为S元素,可推知A为N元素、C为Si.
(1)同主族自上而下非金属性减弱,单质与氢气反应剧烈程度减小,反应热增大(考虑符号);
(2)由工艺流程图可知,原电池原理为SO2+Br2+2H2O=H2SO4+2HBr,分离出硫酸,再电解:2HBr$\frac{\underline{\;电解\;}}{\;}$H2↑+Br2,获得氢气,电解得到的溴循环利用.
①电解槽中电解HBr,生成H2与Br2,反应热=反应物总键能-生成物总键能,注明物质的聚集状态与反应热书写化学方程式;
②分离完全,硫酸中不含HBr,加入AgNO3溶液,根据沉淀颜色判断
③在原电池中,负极发生氧化反应,SO2在负极放电生成H2SO4;
④在电解过程中,电解槽阴极发生还原反应,电极反应式为2H++2e-=H2↑,氢离子浓度降低;
⑤原电池总反应为与电解池总反应相加可得该工艺流程用总反应的化学方程式;该生产工艺的优点:溴可以循环利用,获得清洁能源氢气,缺点是:生成过程有有毒物质,电解循环消耗能源大;
(3)海水提溴过程中,向浓缩的海水中通入氯气,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,同时生成HCO3-或CO2.
解答 解:由短周期元素A、B、C、D在周期表中的位置,可知A、B处于第二周期,C、D处于第三周期,B、D同主族,二者最外层电子数之和为12,则B为O元素、D为S元素,可推知A为N元素、C为Si.
(1)Se与O元素同族元素,同主族自上而下非金属性减弱,单质与氢气反应剧烈程度减小,反应热增大(考虑符号),故生成1mol硒化氢(H2Se)反应热应排在第二位,应为+29.7kJ•mol-1,
故答案为:b;
(2)由工艺流程图可知,原电池原理为SO2+Br2+2H2O=H2SO4+2HBr,分离出硫酸,再电解:2HBr$\frac{\underline{\;电解\;}}{\;}$H2↑+Br2,获得氢气,电解得到的溴循环利用.
①电解槽中电解HBr,生成H2与Br2,反应方程式为2HBr=H2+Br2,由表中数据可知,△H=362kJ/mol×2-436kJ/mol-194kJ/mol=+94kJ/mol,故热化学方程式为2HBr(aq)=H2(g)+Br2(g)△H=+94kJ/mol,
故答案为:2HBr(aq)=H2(g)+Br2(g)△H=+94kJ/mol;
②分离后的H2SO4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到无淡黄色沉淀产生,最终生成白色沉淀,说明分离效果较好,
故答案为:无淡黄色沉淀产生,最终生成白色沉淀;
③在原电池中,负极发生氧化反应,SO2在负极放电生成H2SO4,电极反应式为SO2+2H2O-2e-=4H++SO42-,故答案为:SO2+2H2O-2e-=4H++SO42-;
④在电解过程中,电解槽阴极发生还原反应,电极反应式为2H++2e-=H2↑,氢离子浓度降低,溶液pH变大,
故答案为:变大;
⑤原电池中电池总反应为SO2+Br2+2H2O=H2SO4+2HBr,电解池中总反应为2HBr=H2+Br2,故该工艺流程用总反应的化学方程式表示为:SO2+2H2O=H2SO4+H2,该生产工艺的优点:溴可以循环利用,获得清洁能源氢气,
故答案为:SO2+2H2O=H2+H2SO4;Br2被循环利用或能源循环供给或获得清洁能源;
(3)海水提溴过程中,向浓缩的海水中通入氯气,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴在碳酸钠溶液的歧化可把反应理解为溴与水发生歧化,产生H+的被碳酸钠吸收,反应的离子方程式为3:Br2+6 CO32-+3H2O=5 Br-+BrO3-+6HCO3-(或3 Br2+3CO32-=5 Br-+BrO3-+3CO2↑),
故答案为:Cl2;3 Br2+6 CO32-+3H2O=5 Br-+BrO3-+6HCO3-(或3 Br2+3CO32-=5 Br-+BrO3-+3CO2↑).
点评 本题综合较大,涉及元素推断、化学工艺流程、热化学方程式、原电池及电解原理、海水提取溴等,侧重于学生的分析能力的考查,难度较大,注意基础知识的全面掌握.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
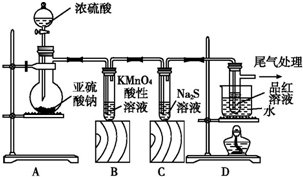
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
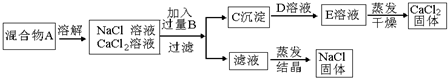
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
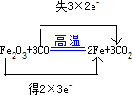 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
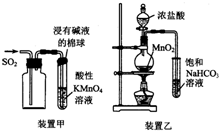
| A. | 用装置甲收集SO2并验证其漂白性 | |
| B. | 用装置乙验证氯气与水反应有盐酸生成 | |
| C. | 用澄清石灰水鉴别苏打溶液和小苏打溶液 | |
| D. | 用NaOH溶液除去苯中混有的少量苯酚,反应后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 开始沉淀的pH值 | 完全沉淀的pH值 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.4 | 4.4 |
| Cr (OH)3 | 4.6 | 5.9 |
| Fe(OH)2 | 7.5 | 9.7 |
| Bi(OH)3 | 0.7 | 4.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com