
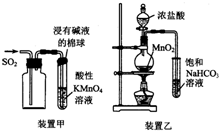
| A. | 用装置甲收集SO2并验证其漂白性 | |
| B. | 用装置乙验证氯气与水反应有盐酸生成 | |
| C. | 用澄清石灰水鉴别苏打溶液和小苏打溶液 | |
| D. | 用NaOH溶液除去苯中混有的少量苯酚,反应后分液 |
分析 A.二氧化硫有还原性;
B.氯化氢易挥发;
C.氢氧化钙和碳酸根离子、碳酸氢根离子都生成碳酸钙沉淀;
D.氢氧化钠与苯酚反应生成苯酚钠,苯酚钠溶于水,苯不与水互溶.
解答 解:A.二氧化硫有还原性,能使酸性高锰酸钾褪色,故A错误;
B.氯化氢易挥发,应除掉后再检验,故B错误;
C.Na2CO3+Ca(OH)2═CaCO3↓+2NaOH、2NaHCO3+Ca(OH)2═CaCO3↓+Na2CO3+2H2O,都出现白色沉淀,无法鉴别,故C错误;
D.氢氧化钠与苯酚反应生成苯酚钠,苯酚钠溶于水,苯不与水互溶,通过反应进行分离,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的检验、分离提纯及物质的性质等,难度不大,注意基础知识的理解掌握.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | |
| C | D |
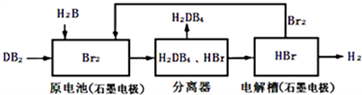
| 化学键 | H-H | Br-Br | H-Br |
| 键能(kJ/mol) | 436 | 194 | 362 |
| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅与苛性钠反应:SiO2+2OH-═SiO32-+H2O | |
| B. | 在NaCl溶液中滴入AgNO3试液:Ag++Cl-═AgCl↓ | |
| C. | Cl2溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 用NaOH溶液吸收Cl2:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
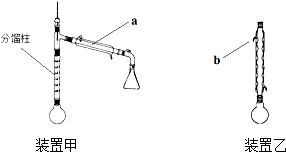 乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下:
乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下: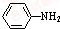 (苯胺)+CH3COOH?
(苯胺)+CH3COOH? (乙酸苯胺)+H2O
(乙酸苯胺)+H2O| 化合物 | 密度(g.cm-3) | 溶解性 | 熔点(℃) | 沸点(℃) |
| 乙酸 | 1.05 | 易溶于水、乙醇 | 17 | 118 |
| 苯胺 | 1.02 | 微溶于水,易溶于乙醇 | -6 | 184 |
| 乙酰苯胺 | - | 微溶于冷水,可溶于热水,易溶于乙醇 | 114 | 304 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-=Al(OH)3↓ | |
| C. | 铁粉与硝酸银溶液反应:Fe+3Ag+=Fe3++3Ag | |
| D. | 醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com