
| A. | 石灰石与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-=Al(OH)3↓ | |
| C. | 铁粉与硝酸银溶液反应:Fe+3Ag+=Fe3++3Ag | |
| D. | 醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O |
分析 A.碳酸钙在离子反应中保留化学式;
B.一水合氨在离子反应中保留化学式;
C.反应生成硝酸亚铁和Ag;
D.反应生成醋酸钠和水.
解答 解:A.石灰石与盐酸反应的离子反应为CaCO3+2H+=Ca2++H2O+CO2↑,故A错误;
B.氯化铝溶液与氨水反应的离子反应为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故B错误;
C.铁粉与硝酸银溶液反应的离子反应为Fe+2Ag+=Fe2++2Ag,故C错误;
D.醋酸与氢氧化钠溶液反应的离子反应为CH3COOH+OH-=CH3COO-+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案科目:高中化学 来源: 题型:选择题
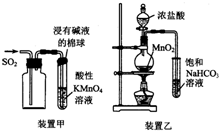
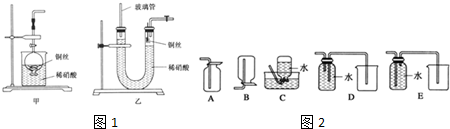
| A. | 用装置甲收集SO2并验证其漂白性 | |
| B. | 用装置乙验证氯气与水反应有盐酸生成 | |
| C. | 用澄清石灰水鉴别苏打溶液和小苏打溶液 | |
| D. | 用NaOH溶液除去苯中混有的少量苯酚,反应后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
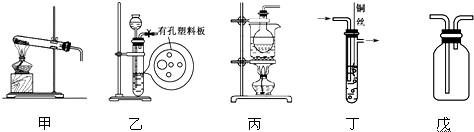
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在酸性条件下,CH3CO18OC2H5水解的产物是CH3CO18OH和C2H5OH | |
| B. | 用甘氨酸(H2NCH2COOH)和丙氨酸(CH3CHNH2COOH)混合缩合,最多可形成3种二肽 | |
| C. | 苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏 | |
| D. | 将电石与饱和食盐水反应生成的气体通入溴的四氯化碳溶液中,若溶液褪色,证明有乙炔生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
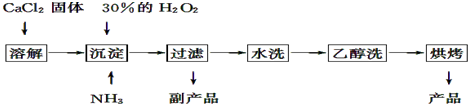
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
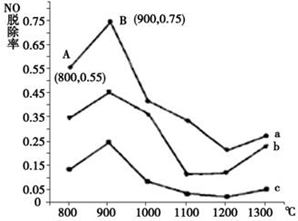 硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.
硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.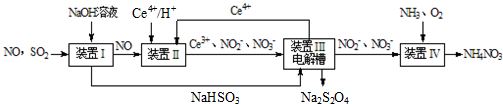
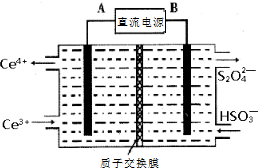
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用硅酸钠与盐酸反应制备硅胶:SiO32-+2H+═H2SiO3(胶体) | |
| B. | FeI2溶液中通入少量Cl2:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 少量NaHSO4 溶液与Ba(OH)2 溶液反应:H++OH-+SO42-+Ba2+═H2O+BaSO4↓ | |
| D. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com