
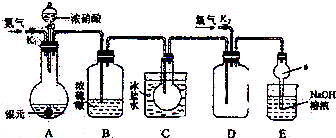


科目:高中化学 来源: 题型:
| A、氧化还原反应中,一种元素化合价升高,一定有另一种元素化合价降低 |
| B、根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 |
| C、根据水溶液能否导电将化合物分为电解质和非电解质 |
| D、碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
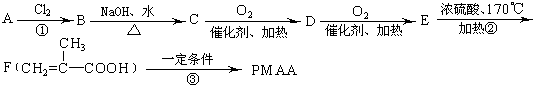
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24 L C4H6中含有碳碳叁键数一定为0.1×6.02×1023 |
| B、在标准状态下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA |
| C、含1molFeCl3的饱和溶液滴入沸水中得到氢氧化铁胶体粒子数目为NA |
| D、120g NaHSO4固体中的离子总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
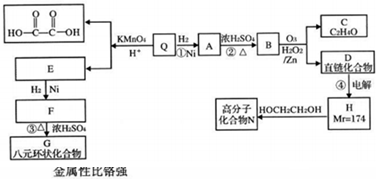
| KMnO4/H+ |
| O3 |
| H2O2/Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使甲基橙变红的溶液中:Ag(NH3)2+、H+、Na+、NO3- |
| B、0.1 mol?L-1 Fe3+溶液中:Cl-、SO42-、K+、C6H5OH |
| C、“84”消毒液的水溶液中:K+、Cl-、Na+、OH- |
| D、通入过量SO2气体的溶液中:K+、NO3-、Ba2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4 |
| B、HCl |
| C、NaOH |
| D、NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由H2、I2(g)、HI组成的平衡体系,加压(缩体积)后颜色加深 |
| B、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| C、实验室中常用排饱和食盐水的方法收集氯气 |
| D、合成氨中增加N2的物质的量浓度可提高H2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com