
| A、由H2、I2(g)、HI组成的平衡体系,加压(缩体积)后颜色加深 |
| B、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| C、实验室中常用排饱和食盐水的方法收集氯气 |
| D、合成氨中增加N2的物质的量浓度可提高H2的转化率 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
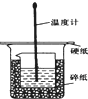 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
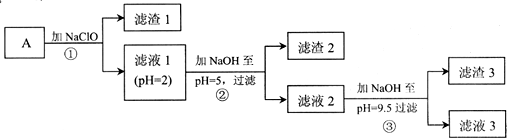
| 物质 | 开始沉淀的pH | 沉淀完全的pH | Kap(25℃) |
| Fe(OH)3 | 2.7 | 3.7 | 4.0×10-38 |
| Fe(OH)2 | 7.6 | 9.6 | 8.0×10-16 |
| Ni(OH)2 | 7.2 | 9.2 | 5.5×10-16 |
| Mg(OH)2 | 9.6 | 11.1 | 1.2×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲、乙两溶液均呈酸性 |
| B、甲、乙两溶液中c(H+)之比为1:2 |
| C、甲、乙两溶液中水的电离程度大小无法比较 |
| D、甲中水的电离程度小于乙中水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K2CO3 |
| B、BaCl2 |
| C、CH3COONa |
| D、Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
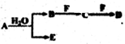 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1-2种短周期元素组成,在一定条件下有如下转化关系,请外完成下列问题:
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1-2种短周期元素组成,在一定条件下有如下转化关系,请外完成下列问题:| 1 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com