
| A、K2CO3 |
| B、BaCl2 |
| C、CH3COONa |
| D、Na2SO4 |


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
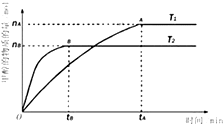 Ⅰ.甲醇是一种新型的能源.
Ⅰ.甲醇是一种新型的能源.| nA |
| tA |
| n(H2) |
| n(CH3OH ) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使甲基橙变红的溶液中:Ag(NH3)2+、H+、Na+、NO3- |
| B、0.1 mol?L-1 Fe3+溶液中:Cl-、SO42-、K+、C6H5OH |
| C、“84”消毒液的水溶液中:K+、Cl-、Na+、OH- |
| D、通入过量SO2气体的溶液中:K+、NO3-、Ba2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| B、制取NaHCO3的反应是利用其溶解度小于NaCl |
| C、在第③、④、⑤步骤中,溴元素均被氧化 |
| D、工业上通过电解饱和MgCl2溶液制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由H2、I2(g)、HI组成的平衡体系,加压(缩体积)后颜色加深 |
| B、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| C、实验室中常用排饱和食盐水的方法收集氯气 |
| D、合成氨中增加N2的物质的量浓度可提高H2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
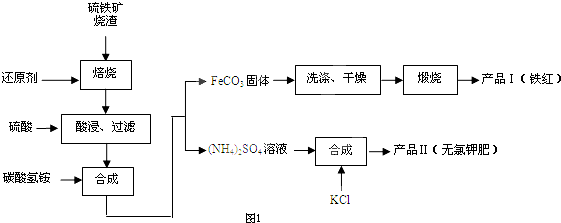
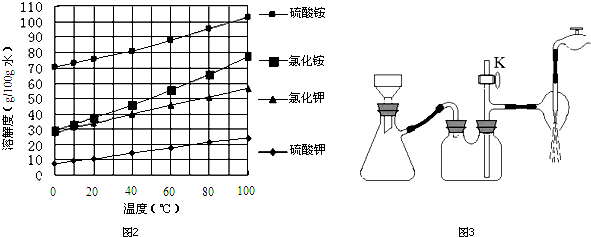
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、若t1=15s,生成物C在 t0~t1时间段的平均反应速率为0.004 mol?L-1?s-1 |
| B、t4~t5阶段改变的条件为减小压强,t5~t6阶段改变的条件是升高化学反应的温度 |
| C、B的起始物质的量为0.02 mol |
| D、该化学反应的表达式为:3A(g)?B(g)+2C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若c1=c2,混合液中c(NH4+)=c(Cl-),则V1>V2 |
| B、若混合溶液的pH=7,则c1V1<c2V2 |
| C、若V1≥V2,c1=c2,则混合液的pH>7 |
| D、若混合溶液的pH>7,则混合液中c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤经气化和液化两个物理变化过程,可变为清洁能源 |
| B、棉、麻、丝、毛、皮以及合成纤维完全燃烧只生成H2O和 CO2 |
| C、“地沟油”可用于制备生物柴油 |
| D、石英玻璃、钢化玻璃、玻璃钢、防弹玻璃都是硅酸盐制品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com