
【题目】硅铁合金广泛应用于冶金工业,可用于铸铁时的脱氧剂、添加剂等,回答下列问题:
(1)基态Fe原子价层电子的电子排布图为________,基态Si原子电子占据最高能级的电子云轮廓图为________形。
(2)绿帘石的组成为![]() ,将其改写成氧化物的形式为_____________.
,将其改写成氧化物的形式为_____________.
(3)![]() 分子的中心原子的价层电子对数为________,分子的立体构型为________;四卤化硅的熔、沸点如下,分析其变化规律及原因________________________________。
分子的中心原子的价层电子对数为________,分子的立体构型为________;四卤化硅的熔、沸点如下,分析其变化规律及原因________________________________。
|
|
|
| |
熔点/K | 182.8 | 202.7 | 278.5 | 393.6 |
沸点/K | 177.4 | 330.1 | 408 | 460.6 |
(4)![]() 可与乙二胺(
可与乙二胺(![]() ,简写为en)发生如下反应:
,简写为en)发生如下反应:![]()
![]() 。
。![]() 的中心离子的配位数为________;
的中心离子的配位数为________;![]() 中的配位原子为________。
中的配位原子为________。
(5)在硅酸盐中,![]() 四面体(图
四面体(图
|
|
图a | 图b |
【答案】![]() 哑铃 4CaOFe2O32Al2O36SiO2H2O 4 正四面体形 熔、沸点依次升高,原因是分子结构相似,相对分子量依次增大,分子间作用力逐渐增强 6 O和N sp3
哑铃 4CaOFe2O32Al2O36SiO2H2O 4 正四面体形 熔、沸点依次升高,原因是分子结构相似,相对分子量依次增大,分子间作用力逐渐增强 6 O和N sp3 ![]() 或Si2O52-
或Si2O52-
【解析】
(1)基态Fe原子价层电子为其3d、4s能级上电子;基态Si原子电子占据的能级有1s、2s、2p,最高能级为2p;
(2)绿帘石的组成为Ca2FeAl2(SiO4) (Si2O7)O(OH),将其改写成氧化物的形式时应结合元素的化合价,依次写出金属氧化物、非金属氧化物、最后是水,并注意原子的最简单整数比不变;
(3)SiCl4分子的中心原子为Si,形成4个σ键,具有甲烷的结构特点;由表中数据可知四卤化硅的沸点逐渐升高,为分子晶体,沸点与相对分子质量有关;
(4)配离子为[Fe(H2O)6]2+,中心离子为Fe3+,配体为H2O,[Fe(H2O)4(en)]2+中配体为H2O和en,根据孤对电子确定配位原子;
(5)硅酸盐中的硅酸根(SiO44-)为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;图中为一种无限长层状结构的多硅酸根,图中一个SiO44-四面体结构单元中其中有3个氧原子的贡献率为![]() 。
。
(1)基态Fe原子的核外价电子排布式为[Ar]3d64S2,基态Fe原子价层电子为其3d、4s能级上电子,则基态Fe原子的核外价电子排布图为![]() ;基态Si原子电子占据的能级有1s、2s、2p,最高能级为2p,其电子云轮廓图为哑铃形;
;基态Si原子电子占据的能级有1s、2s、2p,最高能级为2p,其电子云轮廓图为哑铃形;
(2)绿帘石的组成为Ca2FeAl2(SiO4) (Si2O7)O(OH),将其改写成氧化物的形式为4CaOFe2O32Al2O36SiO2H2O;
(3)SiCl4分子的中心原子为Si,形成4个σ键,价层电子对数为4,具有正四面体结构;四卤化硅的沸点逐渐升高,为分子晶体,沸点与相对分子质量有关,相对分子质量越大,沸点越高;
(4)配离子为[Fe(H2O)6]2+,中心离子为Fe3+,配体为H2O,则配位数为6;![]() 中配体为H2O和en,其中O和N原子均能提供孤对电子,则配位原子为O和N;
中配体为H2O和en,其中O和N原子均能提供孤对电子,则配位原子为O和N;
(5)硅酸盐中的硅酸根(SiO44-)为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;图(b)为一种无限长层状结构的多硅酸根,图(a)中一个SiO44-四面体结构单元中其中有3个氧原子的贡献率为![]() ,SiO44-四面体结构单元含有1个硅、氧原子数目=1+3×
,SiO44-四面体结构单元含有1个硅、氧原子数目=1+3×![]() =2.5,Si、O原子数目之比为1:2.5=2:5,故化学式
=2.5,Si、O原子数目之比为1:2.5=2:5,故化学式![]() 或Si2O52-。
或Si2O52-。


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:
【题目】实验室制得的乙炔中常混有H2S、PH3等杂质气体。如图是两学生设计的实验装置,用来测定CaC2样品的纯度,右边的反应装置相同而左边的气体发生装置则不同,分别如Ⅰ和Ⅱ所示。
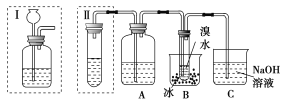
(1)A瓶中的液体可以从酸性KMnO4溶液和FeCl3溶液中选择,应该选择________,它的作用是___________________________。
(2)装置Ⅰ的主要缺点是______________________________________。
(3)装置Ⅱ的主要缺点是_____________________;
若选用此装置来完成实验,则应采取的措施是___________________。
(4)若称取a g CaC2,反应完全后,测得B处溴水增重b g,则CaC2的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X是一种烷烃,是液化石油气的主要成分,可通过工艺Ⅰ的两种途径转化为A和B、C和D。B是一种重要的有机化工原料,E分子中含环状结构,F中含有两个相同的官能团,D是常见有机物中含氢量最高的,H能使![]() 溶液产生气泡,Ⅰ是一种有浓郁香味的油状液体。
溶液产生气泡,Ⅰ是一种有浓郁香味的油状液体。
请回答:
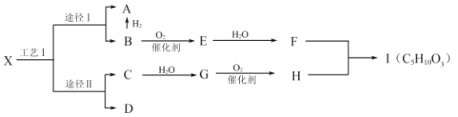
(1)G的结构简式为_________________________。
(2)G→H的反应类型是_________________________。
(3)写出F+H→1的化学方程式_________________________。
(4)下列说法正确的是_______。
A.工艺Ⅰ是石油的裂化
B.除去A中的少量B杂质,可在一定条件下往混合物中通入适量的氢气
C.X、A、D互为同系物,F和甘油也互为同系物
D.H与![]() 互为同分异构体
互为同分异构体
E.等物质的量的Ⅰ和B完全燃烧,消耗氧气的质量比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 按系统命名法,化合物H3CCH(CH2CH3)CH2CH(CH3)2的名称为![]() 甲基
甲基![]() 乙基戊烷
乙基戊烷
B. 等质量的甲烷、乙烯、![]() ,
,![]() 丁二烯分别充分燃烧,所耗用氧气的量依次减少
丁二烯分别充分燃烧,所耗用氧气的量依次减少
C. 苯酚、水杨酸(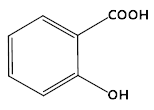 )和苯甲酸都是同系物
)和苯甲酸都是同系物
D. 三硝基甲苯的分子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯胺(![]() )是一种饮用水二级消毒剂,可由以下反应制备:Ⅰ.
)是一种饮用水二级消毒剂,可由以下反应制备:Ⅰ.![]()
![]() 。回答下列问题:
。回答下列问题:
(1)已知:Ⅱ.![]()
![]() Ⅲ.
Ⅲ.![]()
![]() ,则
,则![]() ________(用含
________(用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
(2)向容积均为2 L的甲、乙两个恒温密闭容器中分别加入![]() 和
和![]() ,发生反应Ⅰ,测得两容器中
,发生反应Ⅰ,测得两容器中![]() 随反应时间的变化情况如下表所示:
随反应时间的变化情况如下表所示:
时间/min | 0 | 40 | 80 | 120 | 160 |
容器甲( | 4.0 | 3.0 | 2.2 | 1.6 | 1.6 |
容器乙( | 4.0 | 2.9 | 2.0 | 2.0 | 2.0 |
①0~80 min内,容器甲中![]() ________。
________。
②反应Ⅰ的![]() ________0(填“>”或“<”),其原因为________________________。
________0(填“>”或“<”),其原因为________________________。
③关于反应Ⅰ,下列说法正确的是________(填选项字母)。
a.容器内![]() ,说明反应达到平衡状态
,说明反应达到平衡状态
b.容器内气体密度不变,说明反应达到平衡状态
c.达平衡后,加人一定量![]() ,平衡逆向移动
,平衡逆向移动
d.达平衡后,按原投料比再充入一定量反应物,平衡后![]() 的转化率增大
的转化率增大
④温度为![]() 时HCl(g)的平衡体积分数=________,该温度下,若改为初始体积为2 L的可变容器,平衡时容器中
时HCl(g)的平衡体积分数=________,该温度下,若改为初始体积为2 L的可变容器,平衡时容器中![]() ________(填“>”“=”或“<”)1.6 mol。
________(填“>”“=”或“<”)1.6 mol。
⑤温度为![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() ________。
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叶蝉散是一种新型杀虫剂,防效迅速,且残效不长,对水稻叶蝉和飞虱具有较强的触杀作用。工业上用邻异丙基苯酚合成叶蝉散的过程如下:

邻异丙基苯酚 叶蝉散
下列有关说法不正确的是 ( )
A. 叶蝉散的相对分子质量为193B. 邻异丙基苯酚分子中所有碳原子在同一个平面内
C. 叶蝉散能发生加成、水解反应D. 叶蝉散中不存在手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列![]() 种与人们生产生活相关的有机物:
种与人们生产生活相关的有机物:
①![]() (基础化工原料)②
(基础化工原料)②![]() (防霉剂)③
(防霉剂)③![]() (打火机燃料)④
(打火机燃料)④![]() (冷冻剂)⑤
(冷冻剂)⑤![]() (汽车防冻液)⑥
(汽车防冻液)⑥![]() (杀菌剂)
(杀菌剂)
请回答:
(1)属于醇的是________(填序号)。
(2)与①互为同系物的是________(填序号)。
(3)与③互为同分异构体的是________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是合成治疗心血管疾病药物的中间体,可通过以下途径合成:
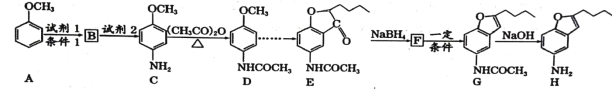
已知:①![]() (苯胺易被氧化)
(苯胺易被氧化)
②甲苯发生一硝基取代反应与A类似。
回答下列问题:
(1)写出化合物H的分子式__________,C中含氧官能团的名称___________。
(2)写出有关反应类型:B![]() C ___________;F
C ___________;F![]() G___________。
G___________。
(3)写出A![]() B的反应方程式:___________________________ 。
B的反应方程式:___________________________ 。
(4)写出同时满足下列条件D的所有同分异构体的结构简式:____________
①能发生银镜反应
②能发生水解反应,水解产物之一与FeCl3溶液反应显紫色
③核磁共振氢谱(1![]() 显示分子中有4种不同化学环境的氢
显示分子中有4种不同化学环境的氢
(5)合成途径中,C转化为D的目的是_____________________。
(6)参照上述合成路线,以甲苯和(CH3CO)2O为原料(无机试剂任选),设计制备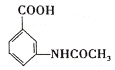 的合成路线:_________________________
的合成路线:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
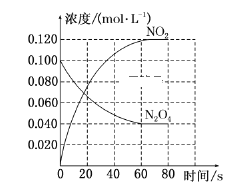
(1)反应的ΔH________(填“大于”或“小于”)0;100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应速率v(N2O4)为______________________________。
(2)100 ℃时达到平衡后,改变反应温度为T,c(N2O4)降低,经10 s又达到平衡。
①T________(填“大于”或“小于”)100 ℃,判断理由是_____________________;
②100 ℃时达到平衡后,向容器中再充入0.20 mol NO2气体,新平衡建立后,NO2的体积分数________(填“增大”“不变”或“减小”)。
(3)温度T时反应达平衡后,将反应容器的容积减小一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com