
【题目】有机物X是一种烷烃,是液化石油气的主要成分,可通过工艺Ⅰ的两种途径转化为A和B、C和D。B是一种重要的有机化工原料,E分子中含环状结构,F中含有两个相同的官能团,D是常见有机物中含氢量最高的,H能使![]() 溶液产生气泡,Ⅰ是一种有浓郁香味的油状液体。
溶液产生气泡,Ⅰ是一种有浓郁香味的油状液体。
请回答:
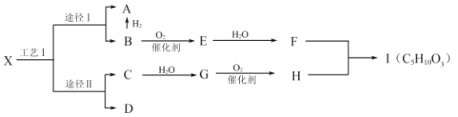
(1)G的结构简式为_________________________。
(2)G→H的反应类型是_________________________。
(3)写出F+H→1的化学方程式_________________________。
(4)下列说法正确的是_______。
A.工艺Ⅰ是石油的裂化
B.除去A中的少量B杂质,可在一定条件下往混合物中通入适量的氢气
C.X、A、D互为同系物,F和甘油也互为同系物
D.H与![]() 互为同分异构体
互为同分异构体
E.等物质的量的Ⅰ和B完全燃烧,消耗氧气的质量比为2:1
【答案】![]() 氧化反应 HOCH2CH2OH+CH3CH2COOH
氧化反应 HOCH2CH2OH+CH3CH2COOH![]() CH3CH2COOCH2CH2OH+H2O DE
CH3CH2COOCH2CH2OH+H2O DE
【解析】
X为烷烃,则途径I、途径II均为裂化反应。B催化加氢生成A,则A、B分子中碳原子数相等。设A、B分子中各有n个碳原子,则X分子中有2n个碳原子,E、F中各有n个碳原子。D是含氢量最高的烃,必为CH4,由途径II各C分子中有2n-1个碳原子,进而G、H分子中也有2n-1个碳原子。据F+H→I(C5H10O3),有n+2n-1=5,得n=2。因此,X为丁烷(C4H10)、A为乙烷(C2H6)、B为乙烯(CH2=CH2),B氧化生成的E为环氧乙烷(![]() )、E开环加水生成的F为乙二醇(HOCH2CH2OH)。C为丙烯(CH3CH=CH2)、C加水生成的G为1-丙醇(CH3CH2CH2OH)、G氧化生成的有酸性的H为丙酸(CH3CH2COOH)。F与H酯化反应生成的I为丙酸羟乙酯(CH3CH2COOCH2CH2OH)。
)、E开环加水生成的F为乙二醇(HOCH2CH2OH)。C为丙烯(CH3CH=CH2)、C加水生成的G为1-丙醇(CH3CH2CH2OH)、G氧化生成的有酸性的H为丙酸(CH3CH2COOH)。F与H酯化反应生成的I为丙酸羟乙酯(CH3CH2COOCH2CH2OH)。
(1)据C→G→I,G只能是1-丙醇,结构简式为CH3CH2CH2OH。
(2)G(CH3CH2CH2OH)→H(CH3CH2COOH)既脱氢又加氧,属于氧化反应。
(3)F+H→I的化学方程式HOCH2CH2OH+CH3CH2COOH![]() CH3CH2COOCH2CH2OH+H2O。
CH3CH2COOCH2CH2OH+H2O。
(4)A.工艺Ⅰ生成乙烯、丙烯等基础化工原料,是石油的裂解,A错误;
B.除去A(C2H6)中的少量B(CH2=CH2)杂质,可将混合气体通过足量溴水。除去混合气体中的杂质,通常不用气体作除杂试剂,因其用量难以控制,B错误;
C.X(C4H10)、A(C2H6)、D(CH4)结构相似,组成相差若干“CH2”,互为同系物。但F(HOCH2CH2OH)和甘油的官能团数目不同,不是同系物,C错误;
D.H(CH3CH2COOH)与![]() 分子式相同、结构不同,为同分异构体,D正确;
分子式相同、结构不同,为同分异构体,D正确;
E.Ⅰ(C5H10O3)和B(C2H4)各1mol完全燃烧,消耗氧气分别为6mol、3mol,其质量比为2:1,E正确。
故选DE。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则下列说法错误的是

A.A与水反应可生成D
B.B常用于制作呼吸面具
C.C与澄清石灰水反应生成白色沉淀和D
D.将稀硫酸铝溶液逐滴滴入D溶液中,开始时就会产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物B是芳香烃的含氧衍生物,其相对分子质量不超过120,B中含氧的质量分数为14.8%,B与NaOH溶液不发生反应。有机物A在一定条件下可发生反应A+H2O![]() B+C。有关C的转化关系如下图所示:
B+C。有关C的转化关系如下图所示:

已知:![]()
根据以上信息,回答下列问题:
(1)B的结构简式为 ,条件I、II中均需要的试剂为 。
(2)有关C的转化关系图中所发生的反应中属于取代反应的有 个。
(3)C的同分异构体中,同时符合下列要求的物质有 种。
a.苯环上有两个侧链 b.能发生银镜反应 c.能发生消去反应
(4)写出G→F转化的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二草酸合铜(Ⅱ)酸钾晶体![]() (其摩尔质量为354g·
(其摩尔质量为354g·![]() ),是一种工业用化工原料。微溶于冷水,微溶于酒精,虽可溶于热水但会慢慢分解,干燥时较为稳定,温度高于260℃易分解。现以胆矾和草酸钾晶体为原料制备二草酸合铜(Ⅱ)酸钾晶体流程如下:
),是一种工业用化工原料。微溶于冷水,微溶于酒精,虽可溶于热水但会慢慢分解,干燥时较为稳定,温度高于260℃易分解。现以胆矾和草酸钾晶体为原料制备二草酸合铜(Ⅱ)酸钾晶体流程如下:

根据以上内容请回答:
(1)冷却混合液时___________(“能”或者“不能”)用冰水加速冷却,原因是_________________
(2)下列说法正确的是_____________。
a.抽滤时选用的滤纸要小于布氏漏斗内径。且能盖住所有小孔
b.洗涤时可用冷水作洗涤剂
c.洗涤固体时,应开大水龙头,使洗涤过程快速完成
d.可以用加热烘干固体法,但加热温度不宜很高
(3)胆矾晶体可以从硫酸铜溶液中获得。具体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗;b.___________________。
②在蒸发浓缩的初始阶段可通过_________(填操作名称)回收乙醇。
(4)准确称取制取的试样1.000g溶于NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL于锥形瓶中,再加入10mL3.000![]() 的
的![]() 溶液,用0.01000
溶液,用0.01000![]() 的
的![]() 溶液滴定,消耗
溶液滴定,消耗![]() 标准液18.00mL,则该产品的纯度是_____________。
标准液18.00mL,则该产品的纯度是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业纯碱中常常含有NaCl、![]() 等杂质。为测定某工业纯碱的纯度。设计了如图实验装置。依据实验设计,请回答:
等杂质。为测定某工业纯碱的纯度。设计了如图实验装置。依据实验设计,请回答:

(1)仪器D的名称是______________;装置D的作用是______________________。
(2)若不考虑操作、药品及其用量等方面的影响,该实验测得结果会___________(填“偏高”、“偏低”,“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气态烃A在一定条件下和B发生下列反应生成物质C,已知烃A在标准状况下的密度为1.16gL-1。
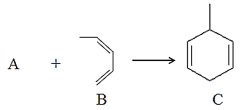
请回答:
(1)A的官能团名称为______________。
(2)上述有机反应类型为____________。
(3)下列说法正确的是________
a.C的密度比水大
b.A、B、C都能与溴水反应
c.C分子中所有碳原子处于同一个平面
d.C分子的一氯代物有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关各装置图的叙述,正确的是

A. 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B. 装置②的总反应式:Cu+2Fe3+==Cu2++2Fe2+
C. 装置③中插入海水中的铁棒,越靠近底端腐蚀越严重
D. 装置④中钢闸门应与外接电源的负极相连被保护,该方法叫做牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅铁合金广泛应用于冶金工业,可用于铸铁时的脱氧剂、添加剂等,回答下列问题:
(1)基态Fe原子价层电子的电子排布图为________,基态Si原子电子占据最高能级的电子云轮廓图为________形。
(2)绿帘石的组成为![]() ,将其改写成氧化物的形式为_____________.
,将其改写成氧化物的形式为_____________.
(3)![]() 分子的中心原子的价层电子对数为________,分子的立体构型为________;四卤化硅的熔、沸点如下,分析其变化规律及原因________________________________。
分子的中心原子的价层电子对数为________,分子的立体构型为________;四卤化硅的熔、沸点如下,分析其变化规律及原因________________________________。
|
|
|
| |
熔点/K | 182.8 | 202.7 | 278.5 | 393.6 |
沸点/K | 177.4 | 330.1 | 408 | 460.6 |
(4)![]() 可与乙二胺(
可与乙二胺(![]() ,简写为en)发生如下反应:
,简写为en)发生如下反应:![]()
![]() 。
。![]() 的中心离子的配位数为________;
的中心离子的配位数为________;![]() 中的配位原子为________。
中的配位原子为________。
(5)在硅酸盐中,![]() 四面体(图
四面体(图
|
|
图a | 图b |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于四个“封管实验”(夹持装置未画出)的说法正确的是( )

A.加热时,①中上部汇集了 NH4Cl 固体,说明 NH4Cl 的热稳定性比较好
B.加热时,②中溶液变红,冷却后又都变为无色
C.加热时,③中溶液变红,冷却后红色褪去,体现了 SO2 的漂白性
D.加热时,④中上部聚集了固体碘,说明碘的热稳定性较差
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com