
【题目】工业上吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)Na2S2O4中S元素的化合价为________。
(2)写出装置Ⅱ中反应的离子方程式______________________________。
(3)装置Ⅲ中电解槽阴极发生的电极反应为_______________________________。
(4)从装置Ⅳ获得粗产品NH4NO3的实验操作依次为________、________、过滤、洗涤等。
【答案】(1)+3
(2)NO+3Ce4++2H2O===3Ce3++NO![]() +4H+;NO+Ce4++H2O===Ce3++NO
+4H+;NO+Ce4++H2O===Ce3++NO![]() +2H+
+2H+
(3)2HSO![]() +2H++2e-===S2O
+2H++2e-===S2O![]() +2H2O
+2H2O
(4)蒸发浓缩 冷却结晶
【解析】(1)Na2S2O4中Na显+1价,O显-2价,则S显+3价。(2)由流程图可知,装置Ⅱ中的反应物是NO、H+、Ce4+,生成物是Ce3+、NO![]() 、NO
、NO![]() ,说明Ce4+可将NO氧化成NO
,说明Ce4+可将NO氧化成NO![]() 和NO
和NO![]() ,本身被还原为Ce3+,由此可写出反应的离子方程式。(3) 由流程图可知,装置Ⅲ电解槽中Ce3+在阳极被氧化成Ce4+,HSO
,本身被还原为Ce3+,由此可写出反应的离子方程式。(3) 由流程图可知,装置Ⅲ电解槽中Ce3+在阳极被氧化成Ce4+,HSO![]() 在阴极被还原为S2O
在阴极被还原为S2O![]() ,溶液呈酸性,由此可写出阴极发生的电极反应式。(4)从NH4NO3溶液中获得NH4NO3固体的操作依次为蒸发浓缩,冷却结晶,过滤,洗涤。
,溶液呈酸性,由此可写出阴极发生的电极反应式。(4)从NH4NO3溶液中获得NH4NO3固体的操作依次为蒸发浓缩,冷却结晶,过滤,洗涤。


科目:高中化学 来源: 题型:
【题目】下列说法错误的有
①化学反应除了生成新物质外,还伴随着能量的变化
②放热反应不需要加热就能发生
③需要加热才能发生的反应都是吸热反应
④化学反应放热还是吸热。决定于生成物具有的总能量和反应物具有的总能量的大小
⑤热化学方程式应注明反应时的温度与压强,如没注明则表示常温常压时的反应
⑥等量的氢气和氧气分别完全燃烧生成气态水和液态水,前者放出的热量多
⑦H2(g)+I2(g) ![]() 2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1mol H2和1mol I2(g)反应生成2 mol HI时放出QkJ的热量
2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1mol H2和1mol I2(g)反应生成2 mol HI时放出QkJ的热量
⑧同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照条件下和点燃条件下的ΔH相同
A. 2项 B. 3项 C. 4项 D. 5项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于晶体和非晶体的说法,正确的是( )
A. 晶体在三维空间里呈周期性有序排列,因此在各个不同的方向上具有相同的物理性质
B. 晶体在熔化过程中需要不断的吸热,温度不断地升高
C. 普通玻璃在各个不同的方向上力学、热学、电学、光学性质相同
D. 晶体和非晶体之间不可以相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下1 L的密闭容器中,反应mA(g)+nB(g) ![]() pC(g)+qD(g)达到平衡。若起始时A为1 mol,反应2min达到平衡,A剩余0.4 mol,则在0~2min内A的平均反应速率为______mol/(Lmin)。
pC(g)+qD(g)达到平衡。若起始时A为1 mol,反应2min达到平衡,A剩余0.4 mol,则在0~2min内A的平均反应速率为______mol/(Lmin)。
(2)在其他条件不变的情况下,扩大容器体积,若平衡向逆反应方向移动,m+n______p+q(选填“>”、“<”或“=”),v逆______(选填“增大”、“减小”或“不变”)。
(3)若反应速率(v)与时间(t)的关系如图所示,则导致t1时刻速率发生变化的原因可能是________。(选填编号,下同)
a.增大A的浓度 b. 缩小容器体积
c. 加入催化剂 d.升高温度
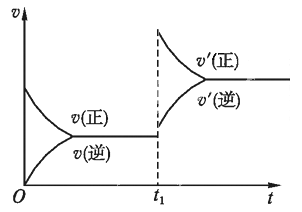
(4)若nV正(A)=mV逆(B),则该反应________。
a.向正反应方向进行 b. 向逆反应方向进行 c.处于平衡状态 d.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为( )
A.1:2:3
B.3:2:1
C.6:3:1
D.6:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配位化合物的数量巨大,组成和结构形形色色,丰富多彩。配合物[Cu(NH3)4](OH)2的中心离子、 配体和配位数分别为( )
A. Cu2+ 、NH3、4 B. Cu+、NH3、4
C. Cu2+ 、OH-、2 D. Cu2+ 、NH3、2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com