
����Ŀ����ʹ������к͵ζ����ⶨ���۰״���������g100ml��1����
��1����ʵ�鲽�裺
�������������ƣ���ȡ10.00mLʳ�ð״ף����ձ�����ˮϡ�ͺ�ת�Ƶ�ת�Ƶ� �����������ƣ��ж��ݣ�ҡ�ȼ��ô���״���Һ��
��2������ʽ�ζ���ȡ����״���Һ20.00mL����ƿ�У������еμ�2����ָʾ����
��3����ȡʢװ0.1000mol/L NaOH��Һ�ļ�ʽ�ζ��ܵij�ʼ������
�ζ�����ʱ��ֹͣ�ζ�������¼NaOH��Һ���ն������ظ��ζ�3�Σ�
��4����ʵ���¼��
������������� | 1 | 2 | 3 | 4 |
V����Ʒ�� | 20.00 | 20.00 | 20.00 | 20.00 |
V��NaOH�������ģ� | 15.95 | 15.00 | 15.05 | 14.95 |
�����ݴ��������ۣ�
��ͬѧ�ڴ�������ʱ����ã�ƽ�����ĵ�NaOH��Һ�����V= ![]() mL=15.24mL��ָ�����ļ���IJ�����֮���� ��
mL=15.24mL��ָ�����ļ���IJ�����֮���� ��
��5����ͬѧ��ϸ�о��˸�Ʒ�ư״ı�ǩ���������л����б���������ΪʳƷ���Ӽ������������Ϸ���֤�����뱽�����Ʋ��ᷢ�����ӽ�����Ӧ���������һ���¶��´���ͱ����������д��ţ�
a�����볣�� b���ܽ��
��6���ڱ�ʵ��ĵζ������У����в�����ʹʵ����ƫ����ǣ���д��ţ� ��
a����ʽ�ζ����ڵζ�ʱδ�ñ�NaOH��Һ��ϴ
b����ʽ�ζ��ܵļ����ڵζ�ǰ�����ݣ��ζ���������ʧ
c����ƿ�м������״���Һ���ټ�����ˮ
d����ƿ�ڵζ�ʱ����ҡ����������Һ�彦����
���𰸡�
��1����ʽ�ζ���,����ƿ
��2����̪
��3����Һ����ɫǡ�ñ�Ϊ��ɫ,���ڰ�����ڲ���ɫ
��4����1�εζ�������Դ�,���쳣ֵ,Ӧ��ȥ
��5��a
��6��ab
���������⣺��1��������Һ����ʽ�ζ�����ȡ��������ʽ�ζ�����ȡ10.00mLʳ�ð״ף����ձ�����ˮϡ�ͺ�ת�Ƶ�100mL ����ƿ�ж��ݣ�ҡ�ȼ��ô���״���Һ��
���Դ��ǣ���ʽ�ζ��ܣ�����ƿ��
��2��ʳ����NaOH��Ӧ������ǿ�������Σ���Һ�ʼ��ԣ�Ӧѡ����Ա�ɫ��Χ�ڵ�ָʾ����̪��
���Դ��ǣ���̪��
��3��NaOH�ζ�ʳ���յ�Ϊ����Һ����ɫǡ�ñ�Ϊ��ɫ�����ڰ�����ڲ���ɫ
���Դ��ǣ���Һ����ɫǡ�ñ�Ϊ��ɫ�����ڰ�����ڲ���ɫ��
��4������ʽ���е���ֵ��֪����1�εζ�������Դ����쳣ֵ��Ӧ��ȥ��
���Դ��ǣ���1�εζ�������Դ����쳣ֵ��Ӧ��ȥ��
��5�����볣��Խ���������Խǿ����Ҫ�Ƚϴ���ͱ���������ԣ���Ҫ֪�����ߵĵ��볣����С��ϵ��
���Դ��ǣ�a��
��6��a����ʽ�ζ����ڵζ�ʱδ�ñ�NaOH��Һ��ϴ����ҺŨ�Ƚ��ͣ����V������ƫ����c�����⣩= ![]() ������֪c�����⣩ƫ��a��ȷ��
������֪c�����⣩ƫ��a��ȷ��
b����ʽ�ζ��ܵļ����ڵζ�ǰ�����ݣ��ζ���������ʧ�����V������ƫ����c�����⣩= ![]() ������֪c�����⣩ƫ��b��ȷ��
������֪c�����⣩ƫ��b��ȷ��
c����ƿ�м������״���Һ���ټ�����ˮ����V��������Ӱ�죬����c�����⣩= ![]() ������֪c�����⣩���䣬��c����
������֪c�����⣩���䣬��c����
d����ƿ�ڵζ�ʱ����ҡ����������Һ�彦��������Һ���ʵ���ƫС�����V������ƫС������c�����⣩= ![]() ������֪c�����⣩ƫС����d����
������֪c�����⣩ƫС����d����
���Դ��ǣ�ab��
�����㾫�����������⣬������Ҫ�˽�����к͵ζ�(�к͵ζ�ʵ��ʱ��������ˮϴ���ĵζ������ñ�Һ��ϴ����װ��Һ�����ô���Һ��ϴ������ȡҺ�壻�ζ��ܶ���ʱ�ȵ�һ�����Ӻ��ٶ������۲���ƿ����Һ��ɫ�ĸı�ʱ���ȵȰ������ɫ�����Ϊ�ζ��յ�)��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ի�ѧ��Ӧ�ȵ�������������ǣ� ��
A.�κο��淴Ӧ����һ������
B.��ѧ��Ӧ�����Dz��ɸı��
C.��ѧ��Ӧ������ʱ��ij�����
D.��ѧ��Ӧ�ﵽ��ʱ�����淴Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2�Ǻ��ɫ�ж��������д̼�����ζ���е�Ϊ11�棬��������ˮ������ˮ��Ӧ������ˮ����ˮ��ɴ����ᡢ����������������Ҳ�ֽ����������Һ�����䰵������ȶ���ijУ����ѧϰС���ͬѧ���Ʊ���������ˮ��Һ�����������ʡ�
��.��������ˮ��Һ�Ʊ���
��Բ����ƿ���ȼ���10gKClO3�����9gH2C2O4��2H2O(����)��Ȼ���ټ���5mLϡ�������ô�������������(����ͼ)������ƿ������ˮԡ�У�����ˮԡ�¶���60��80�棬��B�й��ƿ����Һ������ɫʱֹͣ���ȡ�
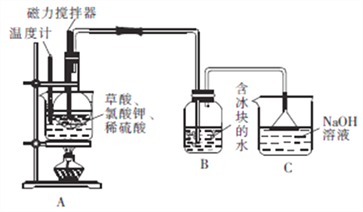
�ش�����������
��1��װ��A��ˮԡ���ȵ��ŵ���_________________��װ��A��ˮԡ�¶Ȳ��˵���60��Ҳ���˸���80�棬��ԭ����______________________��
��2��װ��A�з�Ӧ����ClO2��KHSO4�Ȳ���Ļ�ѧ����ʽΪ_________________��
��3��װ��B��ˮ�����������Ŀ����_________________��װ��C��������_______________
��.���ʵ����֤ClO2�������ԡ�
��4��ȡ����ClO2ˮ��Һ����H2S��Һ������������ɫ��Һ��������H2S����������������Ҫ�õ����Լ���_______________________��
��5��֤��ClO2�������Ա�Fe3+ǿ�ķ�����______________________��
��6��������ClO2ˮ��Һ����ʢ��MnSO4��Һ���Թ����������к�ɫ������������÷�Ӧ�����ӷ���ʽΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO��CO2�ǻ�ʯȼ��ȼ�յ���Ҫ���
��1������0.02 molCO2��0.01molCO�Ļ������ͨ��������Na2O2 ������ܱ������У�ͬʱ���ϵ��õ��ȼ����ַ�Ӧ������������_________g��
��2����֪��2CO(g)+O2(g)=2CO2(g) ��H=-566.0 kJ��mol-1������Eo-o=499.0kJ��mol-1��
�ٷ�Ӧ��CO(g)+O2(g)![]() CO2(g)+O(g)�ġ�H=_________kJ��mol-1��
CO2(g)+O(g)�ġ�H=_________kJ��mol-1��
����֪2500Kʱ�����з�Ӧ��ƽ�ⳣ��Ϊ0.40��ijʱ�̸÷�Ӧ��ϵ�и�����Ũ�����㣺c(CO)��c(O2)=c(CO2)��c(O)�����ʱv(��)_________(�>�� ��������������v���棩��
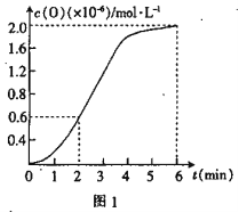
����֪1500��ʱ�����ܱ������з�����Ӧ��CO2(g)![]() CO(g)+O(g)����Ӧ������O(g)�� ���ʵ���Ũ����ʱ��ı仯��ͼ1 ��ʾ����0~2 min �ڣ�CO2 ��ƽ����Ӧ���� v(CO2)=_________��
CO(g)+O(g)����Ӧ������O(g)�� ���ʵ���Ũ����ʱ��ı仯��ͼ1 ��ʾ����0~2 min �ڣ�CO2 ��ƽ����Ӧ���� v(CO2)=_________��
��3����ij�ܱ������з�����Ӧ��2CO2(g)![]() 2CO(g)+O2(g),1molCO2 �ڲ�ͬ�¶��µ�ƽ��ֽ�����ͼ2 ��ʾ��
2CO(g)+O2(g),1molCO2 �ڲ�ͬ�¶��µ�ƽ��ֽ�����ͼ2 ��ʾ��

�����º��������£��ܱ�ʾ�ÿ��淴Ӧ�ﵽƽ��״̬����_________ (����ĸ)��
A��CO ������������ֲ���
B�������ڻ��������ܶȱ��ֲ���
C�������ڻ�������ƽ��Ħ���������ֲ���
D����λʱ���ڣ�����CO ��Ũ�ȵ�������CO2 ��Ũ��
������ͼ2����1500��ʱ��Ӧ�ﵽƽ��״̬�����������Ϊ1L�����ʱ��Ӧ��ƽ�ⳣ�� K=_________(����������1 λС��)��
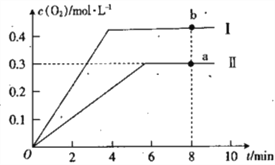
��������ܱ������г���2molCO2(g)��������Ӧ��2CO2(g)![]() 2CO(g)+O2(g)������¶�ΪT��ʱ��������O2�����ʵ���Ũ����ʱ��ı仯������II ��ʾ��ͼ������I ʾ���������II���ı�һ�ַ�Ӧ������c(O2)��ʱ��ı仯����ı��������_________��a�� ������COŨ�ȱ仯��ʾ�ľ���Ӧ���ʹ�ϵΪva(CO)_________(�>����<����=��) vb( CO)��
2CO(g)+O2(g)������¶�ΪT��ʱ��������O2�����ʵ���Ũ����ʱ��ı仯������II ��ʾ��ͼ������I ʾ���������II���ı�һ�ַ�Ӧ������c(O2)��ʱ��ı仯����ı��������_________��a�� ������COŨ�ȱ仯��ʾ�ľ���Ӧ���ʹ�ϵΪva(CO)_________(�>����<����=��) vb( CO)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. �������ļ������ϩ��ȫȼ�գ��������ĵ�O2��
B. C5H11Cl��6��ͬ���칹��
C. ����ϩ����ϩ�������ƣ���ʹ��ˮ��ɫ
D. ��������춡�黥Ϊͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ı仯�ͷ�Ӧ�Ŀ����ȽǶ��о���ѧ��Ӧ������Ҫ���塣
(1)��֪һ�������£���ӦN2+3H2=2NH3Ϊ���ȷ�Ӧ��
����ͼ����ȷ��ʾ�÷�Ӧ�������仯����____��
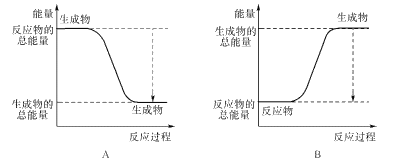
�ڸ����±����ݣ���������1 molNH3ʱ�÷�Ӧ�ų�������Ϊ____kJ��

��һ���¶��£���3 molH2��1 molN2ͨ���ݻ�Ϊ2L���ܱ������з�����Ӧ��5 min�ﵽƽ�⣬���c(NH3)=0.6 mol��L����0��5 minʱv(N2)=___���ﵽƽ��ʱH2��ת����Ϊ____��
(2)ij��ȤС��Ϊ�о�ԭ���ԭ���������ͼװ�á�
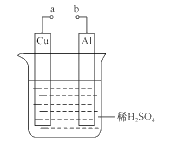
��a��b�õ������ӣ�Cu��Ϊԭ���____������������������缫��Ӧʽ��____��Al������____�����������ԭ������Ӧ����缫��ӦʽΪ____����Һ��SO42-����____���Cu����Al����������ҺpH____����������С���������������ܽ�5.4gʱ��____NA����ͨ�����ߡ�
�ڲ���a��b���ӣ�������μӿ�Al��ϡ����ķ�Ӧ���ʣ�_______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ������������ȷ���ǣ� ��
A.������������ˮ�������Ӽ����ƻ����й��ۼ����ƻ�
B.���ʷ����о������ۼ�
C.HF��HBr��ȣ������ڹ��ۼ���ǿ������HF�е����
D.�ɲ�ͬԪ����ɵĶ�ԭ�ӷ����ֻ���ڼ��Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��������������Һ�У��ܹ������������
A.NH4����Cl����Fe3����K��B.Na����CO32����Ca2����Cl��
C.MnO4-��Fe2+��Na+��SO42��D.K+��SO42����HCO3-��Na+
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com