
| A. | 热稳定性:Na2CO3>NaHCO3 | B. | 酸性:H2CO3>HClO | ||
| C. | 氧化性:浓硝酸>稀硝酸 | D. | 结合OH-的能力:NH4+>Al3+ |
分析 A.碳酸氢钠加热分解生成碳酸钠;
B.二氧化碳与NaClO反应生成HClO;
C.硝酸浓度越大,氧化性越强;
D.Al3+先与碱反应,然后NH4+再与碱反应.
解答 解:A.碳酸氢钠加热分解生成碳酸钠,则热稳定性:Na2CO3>NaHCO3,故A正确;
B.二氧化碳与NaClO反应生成HClO,发生强酸制取弱酸的反应,则酸性:H2CO3>HClO,故B正确;
C.硝酸浓度越大,氧化性越强,则氧化性:浓硝酸>稀硝酸,故C正确;
D.含NH4+、Al3+的混合溶液中Al3+先与碱反应,然后NH4+再与碱反应,则结合OH-的能力:NH4+<Al3+,故D错误;
故选D.
点评 本题考查周期表和周期律的综合应用,为高频考点,把握元素的位置、元素的性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
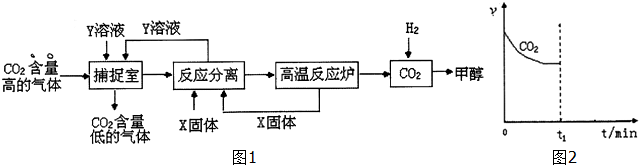
 | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 0.9×10-3 | 2.7×10-3 | 8.1×10-3 |
| t2 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
| t3 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3+6NH3•H2O=3(NH4)2SO4+2Fe(OH)3↓ | |
| B. | FeCl3+3NaOH=Fe(OH)3↓+3NaCl | |
| C. | Fe2(SO4)3+3Ba(OH)2=2Fe(OH)3↓+3BaSO4↓ | |
| D. | FeCl2+2KOH=Fe(OH)2↓+2KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、CO2性质相似,都能在水溶液中被氯气氧化 | |
| B. | Na2O2、Na2O组成元素相同,与CO2反应产物也相同 | |
| C. | Mg和K在一定条件下与水反应都生成H2和对应的碱 | |
| D. | Na、Li同属于碱金属单质,在加热条件下与氧气反应都生成过氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含质子数=A-n | B. | 质子数=Z+A | C. | 所含电子数=Z+n | D. | 所含中子数=A-Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只用溴水一种试剂就可鉴别乙烯、乙醇、四氯化碳四种物 | |
| B. | 将乙醇加热到170℃可制得乙烯 | |
| C. | 除去乙酸乙酯中的少量乙酸:加入NaOH溶液,振荡、静置后,分液 | |
| D. | 提取溶解在水中的少量碘:加入乙醇,振荡、静置分层后,取出有机层再分 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com