
 | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 0.9��10-3 | 2.7��10-3 | 8.1��10-3 |
| t2 | 2.4��10-3 | 4.8��10-3 | 9.4��10-3 |
| t3 | 2.4��10-3 | 4.8��10-3 | 9.4��10-3 |
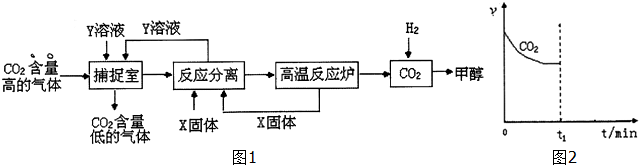
���� ��1��A��NaOH��Һ��ˮ���ܲ������е�CO2��õ�̼�����ơ�̼�������Һ������CaO����õ�̼��ƣ��������ƻ��������������백������ѭ�����ã�̼��Ʒֽ�õ�CuO�������̼��CaOѭ�����ã�
B���¶ȹ��ߣ�̼�����ơ�̼��������ֽ⣻
C�����Ÿ�Ч������ֽ�ˮ�����������Խ����ܺģ�
D��̼��Ʒֽ��ܺĴ��Ʊ������ܺĴ�
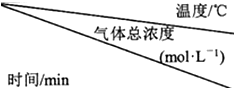
��2���ٲ�ͬ�¶������£�t2��t3ʱ�̻��������Ũ�Ȳ��䣬˵��t2ʱ�̾�����ƽ�⣬�������¶�ƽ��ʱ���������Ũ������˵�������¶�ƽ�������ƶ���
�ɷ���ʽ��֪��������а����������̼��Ũ��֮��Ϊ2��1�����㰱����Ũ�ȣ��ٸ���v=$\frac{��c}{��t}$���㰱����ʾ�ķ�Ӧ���ʣ�
�ڰ����������̼��Ũ��֮��Ϊ2��1�����Լ��㰱����������̼����Ũ�ȣ��ٸ���K=$\frac{1}{{c}^{2}��N{H}_{3}����c��C{O}_{2}��}$����ƽ�ⳣ����
��3�������������ٳ���1mol CO2��3mol H2��ƽ�������ƶ���˲��CH3OH��������v��CH3OH������С�ڶ�����̼��ʼ���ʣ����º�ѹ�£���ԭƽ��Ϊ��Чƽ�⣬ƽ��ʱ������̼��Ũ����ȣ���������ԭƽ����ȣ����ڶ�����̼��״�Ϊ1��1��Ӧ����ƽ��ʱ������̼������������״�������������ȣ�
�ں��º����£���ԭ���������м���2mol CO2��6mol H2���뿪ʼ����1mol CO2��3mol H2��ȣ�ѹǿ����һ����ƽ�������ƶ�����Ӧ��ת��������
��� �⣺��1��A��NaOH��Һ��ˮ���ܲ������е�CO2��õ�̼�����ơ�̼�������Һ������CaO����õ�̼��ƣ��������ƻ��������������백������ѭ�����ã�̼��Ʒֽ�õ�CuO�������̼��CaOѭ�����ã���A��ȷ��
B���¶ȹ��ߣ�̼�����ơ�̼��������ֽ⣬�����ڶ�����̼�IJ�����B����
C�����Ÿ�Ч������ֽ�ˮ�����������Խ����ܺģ���C��ȷ��
D��������CO2���Ʊ�����������Ʒ�����������������ŷţ���̼��Ʒֽ��ܺĴ��Ʊ������ܺĴ�D����
��ѡ��BD��
��2���ٲ�ͬ�¶������£�t2��t3ʱ�̻��������Ũ�Ȳ��䣬˵��t2ʱ�̾�����ƽ�⣬�������¶�ƽ��ʱ���������Ũ������˵�������¶�ƽ�������ƶ���������ӦΪ���ȷ�Ӧ��
�ɷ���ʽ��֪��������а����������̼��Ũ��֮��Ϊ2��1����25�棬0-t1ʱ���ڲ�������Ũ��Ϊ2.7��10-3mol/L��$\frac{2}{3}$=1.8��10-3mol/L��������ƽ������Ϊ��$\frac{1.8��1{0}^{-3}mol/L}{{t}_{1}min}$=$\frac{1.8}{{t}_{1}}$��10-3mol/��L��min����
�ʴ�Ϊ�����ȣ�$\frac{1.8}{{t}_{1}}$��10-3mol/��L��min����
�ڰ����������̼��Ũ��֮��Ϊ2��1��15��ƽ��ʱ����Ũ��Ϊ2.4��10-3mol/L��$\frac{2}{3}$=1.6��10-3mol/L��������̼��Ũ��Ϊ2.4��10-3mol/L-1.6��10-3mol/L=8��10-4mol/L����ƽ�ⳣ��K=$\frac{1}{{c}^{2}��N{H}_{3}����c��C{O}_{2}��}$=$\frac{1}{��1.6��1{0}^{-3}��^{2}��8��1{0}^{-4}}$=4.9��108��
�ʴ�Ϊ��4.9��108��
��3�������������ٳ���1mol CO2��3mol H2��ƽ�������ƶ���˲��CH3OH��������v��CH3OH������С�ڶ�����̼��ʼ���ʣ����º�ѹ�£���ԭƽ��Ϊ��Чƽ�⣬ƽ��ʱ������̼��Ũ����ȣ���������ԭƽ����ȣ����ڶ�����̼��״�Ϊ1��1��Ӧ����ƽ��ʱ������̼������������״�������������ȣ�CH3OH��������v��CH3OH����ʱ��Ĺ�ϵ����Ϊ��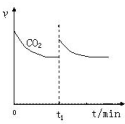 ��
��
�ʴ�Ϊ�� ��
��
�ں��º����£���ԭ���������м���2mol CO2��6mol H2���뿪ʼ����1mol CO2��3mol H2��ȣ�ѹǿ����һ����ƽ�������ƶ�����Ӧ��ת����������ų�������b��2a��
�ʴ�Ϊ��b��2a��
���� ���⿼�黯ѧ��������ѧƽ�������Ӱ�����أ�����������ѧ���������⡢����������������3������ͼΪ�״��㣬ѧ�����������仯���ƣ����Ա仯˲����ƽ��ʱ���ʣ�


 ǧ�������������ĩ�����Ծ�����ϵ�д�
ǧ�������������ĩ�����Ծ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
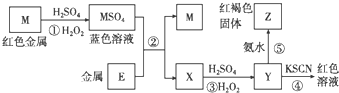
| A�� | E2+�������Ա�M2+��������ǿ | |
| B�� | �ڢ۷�Ӧ��������ϡ������ܿ������ɫ���� | |
| C�� | ��Ӧ�ܵ����ӷ���ʽ�ɱ�ʾΪ��E3++3SCN-?E��SCN��3�� | |
| D�� | �ڷ�Ӧ����ֻ����Ũ���ᣬ�ȱ��������ԡ��ֱ����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| X | ||
| M |
 ��
��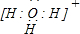 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
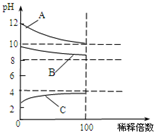 ���г���ʱŨ����ͬ�����ֵ������Һ����CH3COOH ��Na2CO3 ��HNO3��CH3COONa ��NaOH
���г���ʱŨ����ͬ�����ֵ������Һ����CH3COOH ��Na2CO3 ��HNO3��CH3COONa ��NaOH�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �ζ����� | ����Һ�����mL�� | �����������mL�� | |
| �ζ�ǰ������mL�� | �ζ��������mL�� | ||
| ��һ�� | 10.00 | 0.50 | 20.40 |
| �ڶ��� | 10.00 | 4.00 | 24.10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ���� | �۵�� | �е�� | �ܽ��� | ||
| ˮ | �� | �� | |||
| ŨH2SO4 | 10.35 | 340 | ���� | ���� | ���� |
| ���� | -89.12 | 34.5 | �ܣ�������Һ���ܽ�Ƚ��ͣ� | ���� | ���� |
| �Ҵ� | -114.5 | 78.4 | ������ | ������ | ������ |
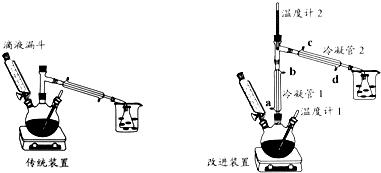
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
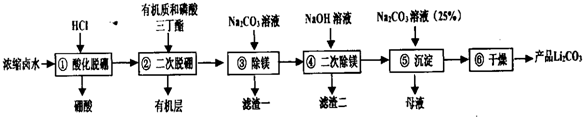
| ���� | MgCO3 | Li2CO3 | Mg��OH��2 |
| Ksp | 6.82��10-6 | 8.2��10-4 | 5.6��10-12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
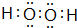
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ȶ��ԣ�Na2CO3��NaHCO3 | B�� | ���ԣ�H2CO3��HClO | ||
| C�� | �����ԣ�Ũ���ϡ���� | D�� | ���OH-��������NH4+��Al3+ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com