
| A. | 在N2+3H2?2NH3的平衡体系中,缩小体积,平衡向右移动,氨的产率增加 | |
| B. | 在CH3COOH?CH3COO-+H+的平衡体系中加入CH3COONa固体,平衡向左移动 | |
| C. | 对Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),升高温度,其Ksp一定增大 | |
| D. | 在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动 |
分析 A、在N2+3H2?2NH3的平衡体系中,缩小体积,相当于增大压强,平衡向气体体积缩小的方向移动;
B、同离子效应;
C、升高温度,氢氧化钙的溶解度减小,所以溶液中钙离子和氢氧根离子的浓度减小,则Ksp减小;
D、稀盐酸能与CO32-反应,促进碳酸钙的沉淀溶解平衡向正方向移动.
解答 解:A、在N2+3H2?2NH3的平衡体系中,缩小体积,相当于增大压强,平衡向气体体积缩小的方向移动,平衡正向移动,氨的产率增加,故A正确;
B、根据同离子效应,在CH3COOH?CH3COO-+H+的平衡体系中加入CH3COONa固体,平衡逆向移动,故B正确;
C、升高温度,氢氧化钙的溶解度减小,所以溶液中钙离子和氢氧根离子的浓度减小,则Ksp减小,而不是增大,故C错误;
D、碳酸钙的沉淀溶解平衡为:CaCO3(s)?Ca2+(aq)+CO32-(aq),加入稀盐酸能与CO32-反应,促进碳酸钙的沉淀溶解平衡向正方向移动,故D正确;
故选C.
点评 本题考查了电离平衡移动的影响因素和溶液的pH变化,注意从影响弱电解质电离平衡移动的因素分析,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定温度下,在冰醋酸加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.下列说法正确的是( )
一定温度下,在冰醋酸加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.下列说法正确的是( )| A. | a、c两点pH不同 | |
| B. | 向c溶液中加水,溶液中所有离子浓度都减小 | |
| C. | 误用湿润的pH试纸测b点pH结果偏大 | |
| D. | $\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$b点大于c点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 4:1 | D. | l:l |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若丙醇中的氧为188O,它与乙酸反应生成的酯的相对分子质量是104 | |
| B. | 用乙酰水杨酸 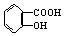 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备 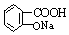 | |
| C. | 向柠檬醛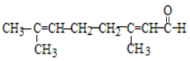 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 | |
| D. | 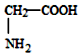 、 、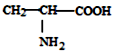 、 、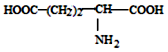 三种氨基酸脱水,最多可生成 6种二肽 三种氨基酸脱水,最多可生成 6种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol•L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①②⑤⑥ | C. | ①②③⑤ | D. | ①②③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com