
| A. | ①②③④⑤⑥ | B. | ①②⑤⑥ | C. | ①②③⑤ | D. | ①②③⑤⑥ |
分析 ①MgO与盐酸反应生成盐和水;
②CuSO4+H2S═CuS↓+H2SO4为弱酸与盐的反应;
③HCl+CH3COONa=CH3COOH+NaCl为复分解反应,为强酸制取弱酸的反应;
④2H2S+H2SO3=3H2O+S↓反应后显中性;
⑤氧气转化为臭氧,无元素的化合价变化;
⑥二氧化碳与过氧化钠反应生成氧气.
解答 解:①MgO与盐酸反应生成盐和水,则酸性氧化物与碱发生反应可实现,故选;
②CuSO4+H2S═CuS↓+H2SO4为弱酸与盐的反应,则弱酸与盐溶液反应可以生成强酸可实现,故选;
③HCl+CH3COONa=CH3COOH+NaCl为复分解反应,为强酸制取弱酸的反应,则没有水生成,也没有沉淀和气体生成的复分解反应可发生,故选;
④2H2S+H2SO3=3H2O+S↓反应后显中性,则两种酸溶液充分反应后的溶液体系为中性,故选;
⑤氧气转化为臭氧,无元素的化合价变化,为非氧化还原反应,故选;
⑥二氧化碳与过氧化钠反应生成氧气,则两种氧化物反应的产物有气体可实现,故D选;
故选A.
点评 本题考查酸碱盐的反应,为高频考点,把握物质性质、发生的反应、常见的实例为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在N2+3H2?2NH3的平衡体系中,缩小体积,平衡向右移动,氨的产率增加 | |
| B. | 在CH3COOH?CH3COO-+H+的平衡体系中加入CH3COONa固体,平衡向左移动 | |
| C. | 对Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),升高温度,其Ksp一定增大 | |
| D. | 在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 影响化学反应速率的主要因素是内因,即反应物本身的性质 | |
| B. | 增大反应物浓度,活化分子百分数不变,单位体积内活化分子数增多 | |
| C. | 升高温度,活化分子百分数增大,分子有效碰撞的频率增大,化学反应速率加快 | |
| D. | 使用正催化剂,活化分子百分数不变,但是反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
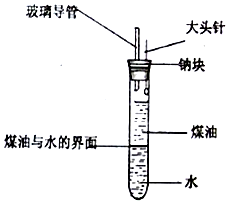 某化学研究性学习小组设计了如图所示的实验装置,目的是做钠与水反应的实脸并验证①钠的物理性质;②钠和水反应的产物.请回答下列问题:
某化学研究性学习小组设计了如图所示的实验装置,目的是做钠与水反应的实脸并验证①钠的物理性质;②钠和水反应的产物.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(a+b)}{4}$ mol/L | B. | 4(3a+b) mol/L | C. | 4(a+b) mol/L | D. | $\frac{(3a+b)}{4}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
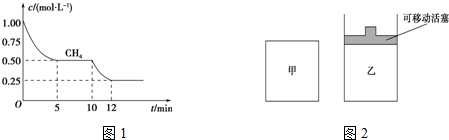
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com