
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下反应关系:
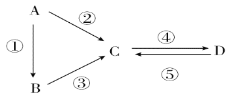
(1)若B是淡黄色固体,反应②③均用到同一种液态氢化物。D物质常用于食品工业。写出反应④的化学方程式: _________________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。写出反应③的化学方程式: __________________________________________。
(3)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素位于同一主族,且溶液均显碱性。写出反应②的化学方程式: ___________________________。
(4)若D物质具有两性,反应②③均要用强碱溶液,反应④是通入过量的一种引起温室效应的主要气体。写出反应④的离子方程式: ____________________________________。
(5)若A是应用最广泛的金属。反应④用到A,反应②⑤均用到同一种非金属单质。写出反应④的离子方程式: _____________________________________________。
【答案】NaOH+CO2=NaHCO3 4NH3+5O2![]() 4NO+6H2O Si+2NaOH+H2O=Na2SiO3+2H2↑ AlO+CO2+2H2O=Al(OH)3↓+HCO3- 2Fe3++Fe=3Fe2+
4NO+6H2O Si+2NaOH+H2O=Na2SiO3+2H2↑ AlO+CO2+2H2O=Al(OH)3↓+HCO3- 2Fe3++Fe=3Fe2+
【解析】
(1)若B是淡黄色固体,反应②③均用到同一种液态氢化物。D物质常用于食品工业。则A是Na,B是Na2O2,液态氢化物是H2O,C是NaOH,D是NaHCO3,则反应④的化学方程式NaOH+CO2=NaHCO3;
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染,判断为NO、NO2,A是N2,B为NH3,反应③是氨气的催化氧化反应,化学方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(3)若A是太阳能电池用的光伏材料,判断A为Si,C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性,说明盐水解呈碱性,C为Na2SiO3,D为Na2CO3,B为SiO2;反应②Si变为Na2SiO3反应,Si与NaOH溶液反应产生硅酸钠和氢气,反应的化学方程式为:Si+2NaOH+H2O=Na2SiO3+2H2↑;
(4)若D物质具有两性推断D为Al(OH)3,④反应是通入过量的一种引起温室效应的主要气体,说明C为偏铝酸钠NaAlO2,②③反应均要用强碱溶液,判断A为单质Al,B为AlCl3,反应④为向偏铝酸钠溶液中通入足量CO2气体,产生Al(OH)3沉淀的反应,方程式为:AlO+CO2+2H2O=Al(OH)3↓+HCO3-;
(5)若A是应用最广泛的金属.推断为Fe,④反应用到A,②⑤反应均用到同一种非金属单质,推断该非金属单质为Cl2,可判断C为FeCl3,D为FeCl2,B为Fe2O3,C→D的离子方程式为:Fe+2Fe3+=3Fe2+,若A是应用最广泛的金属。反应④是Fe3+变为Fe2+,离子方程式为2Fe3++Fe=3Fe2+。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可用H2C2O4·2H2O(M=126g/mol)表示,其中混有不参与反应的杂质,为了测定草酸晶体的纯度,进行如下实验:称取m g样品,配成250mL水溶液。量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为c mol·L-1的KMnO4溶液滴定,所发生的反应: KMnO4+ H2C2O4+ H2SO4 = K2SO4+ CO2↑+ MnSO4+ H2O.试回答:
(1)写出该反应的离子方程式并配平:_________________________________________,该反应发生时产生气体先慢后快的原因是_______________________________________________
(2)实验中,KMnO4溶液应装在_____式滴定管中,因为 ___________________。
(3)滴定过程中需要加入的指示剂为___________(填指示剂的名称或“不需要”),确定反应达到滴定终点时的现象是______________________________________。
(4)在滴定过程中若用c mol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为____________mol·L-1,由此可计算样品中草酸晶体的纯度是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量转化的认识不正确的是( )
A.绿色植物的光合作用是将光能转化为化学能
B.煤燃烧时化学能转化成热能和光能
C.原电池工作时,化学能转化为电能
D.白炽灯工作时,电能全部转化为光能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段.如图是硫元素的常见化合价与部分物质类别的对应关系:

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______(填化学式).
(2)将X与Y混合,可生成淡黄色固体.该反应中氧化剂与还原剂的物质的量之比为_______.
(3)检验物质Y的方法是_______________________________.
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______.
(5)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号).
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr207氧化为Na2SO4则24mL 0.05molL﹣1的Na2SO3溶液与 20mL 0.02molL﹣1的溶液恰好反应时,Cr元素在还原产物中的化合价为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.76g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2气体1792mL(标准状况),向反应后的溶液中加入适量的1.0 mol/LNaOH溶液,恰好使溶液中的金属离子全部沉淀。下列说法不正确的是
A. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
B. 浓硝酸在反应中表现了氧化性和酸性,且表现氧化性的硝酸的物质的量为0.08 mol
C. 得到沉淀的质量为3.12g
D. 加入NaOH溶液的体积是50 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Zn+H2SO4=ZnSO4+H2↑下列措施能使产生氢气的速率加快的是
A. 将锌粉替换为锌片B. 向反应的溶液中入氯化钠溶液
C. 将锌与稀硫酸的反应温度升高D. 向反应的溶液中加入硫酸钠固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对上题,反应开始至2 min,Z的平均反应速率为( )
A. 0.05 mol/(L·s)B. 0.01 mol/(L·s)
C. 0.01mol/(L·min)D. 0.05 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物X和Y都是从樟脑科植物中提取的香料。X可按如图路线合成Y。

已知:①RCH-CHR’![]() RCHO+R’CHO
RCHO+R’CHO
②不含α-氢原子(与醛基直接相连的碳上的氢)的醛在浓碱作用下醛分子自身同时发生氧化与还原反应,生成相应的羧酸(在碱溶液中生成羧酸盐)和醇的反应。
如:2HCHO![]() HCOOH+CH3OH
HCOOH+CH3OH
(1)X的官能团名称为___________。
(2)Y的结构简式为___________。
(3)D+G→Y的有机反应类型为___________。
(4)下列物质不能与D反应的是___________(选填序号)
a.金属钠 b.氢溴酸 c.碳酸钠溶液 d.乙酸
(5)写出下列反应方程式:X→G的第①步反应_____________________________。E→F___________________________________。
(6)G有多种同分异构体,写出同时满足下列条件的G的所有同分异构体的结构简式______________(不考虑空间立体异构)。
i.能发生银镜反应 ⅱ.能发生水解反应 ⅲ.苯环上只有一个取代基
(7)G的另一种同分异构体H的结构简式为![]() 下,写出以
下,写出以![]() 为有机原料,制取H的合成路线(可任选无机原料)
为有机原料,制取H的合成路线(可任选无机原料) ![]() →___________。
→___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 用氨水吸收少量SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B. 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
C. FeO和稀HNO3的反应:FeO+2H+=Fe2++H2O
D. 碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com