
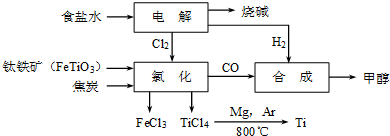
��ұ�������ȼ���״������һ����ҵ������ͼ��ʾ��������������Դ�������ʣ����ٻ�����Ⱦ��

��ش��������⣺
��1��Ti��ԭ������Ϊ22��Tiλ��Ԫ�����ڱ��е�_______���ڣ���______�塣
��2��д���������ڸ������뽹̿���Ȼ��õ����Ȼ��ѵĻ�ѧ����ʽ ��
��3���Ʊ�TiO2�ķ���֮һ������TiCl4ˮ������TiO2��x H2O���پ������Ƶá�ˮ��ʱ����������ˮ�����ȣ����ϻ�ѧ����ʽ�ͱ�Ҫ������˵��ԭ�� ��
��4����TiCl4��Ti ��Ҫ��Ar���н��е�������_________________________________����Ӧ��õ�Mg��MgCl2��Ti�Ļ����ɲ����������ķ�������õ�Ti�������±���Ϣ������ȵ��¶��Ը��� �漴�ɡ�
|
|
TiCl4 |
Mg |
MgCl2 |
Ti |
|
�۵�/�� |
��25.0 |
648.8 |
714 |
1667 |
|
�е�/�� |
136.4 |
1090 |
1412 |
3287 |
��5����������ԭ�ζ����ⶨTiO2������������һ�������£���TiO2�ܽⲢ��ԭΪTi3+ ��
����KSCN��Һ��ָʾ������NH4Fe(SO4)2����Һ�ζ�Ti3+��ȫ������Ti4+���ζ�����ʱ����ȡTiO2��Ħ������ΪM g/mol������w g������c mol/L NH4Fe(SO4)2����ҺV mL����TiO2��������Ϊ___________________�����ô���ʽ��ʾ��
��6����CO��H2�ϳɼ״��ķ���ʽ�ǣ�CO(g)��2H2(g)  CH3OH(g)�����������������������ʵ��κ���ʧ��������ҵ����ÿ�ϳ�6mol�״�����������ⲹ��H2
mol��
CH3OH(g)�����������������������ʵ��κ���ʧ��������ҵ����ÿ�ϳ�6mol�״�����������ⲹ��H2
mol��
��1���ģ�IVB��2�֣�
��2��2FeTiO3+6C+7Cl2 2FeCl3+ 2TiCl4+6CO��2�֣�
2FeCl3+ 2TiCl4+6CO��2�֣�
��3��TiCl4+(2+x)H2O TiO2��xH2O+4HCl���������ˮ�����ȣ��Ȼ���ӷ���ʹƽ�������ƶ����ٽ�ˮ��������ȫ�����ʹˮ��������У� ��2�֣�
TiO2��xH2O+4HCl���������ˮ�����ȣ��Ȼ���ӷ���ʹƽ�������ƶ����ٽ�ˮ��������ȫ�����ʹˮ��������У� ��2�֣�
��4����ֹ�ѡ�þ�����������ֹ��þ�������ˮ��Ӧ����2�֣���1412��2�֣�
��5�� ����
����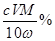 %����2�֣�
%����2�֣�
��6��5��2�֣�
��������
����������������������������Ϣ����������ͼ��֪��2���еķ���ʽΪ2FeTiO3+6C+7Cl2 2FeCl3+
2FeCl3+
2TiCl4+6CO��ͬ����3��Ҳ��Ҫ������ʾ���û�ѧƽ����ƶ�ԭ�����⣻��4���н�ϸ������ʵ��۷е�ȷ���¶��Ը���14120C�ɽ�Ti���룬����5����������������ԭ��Ӧ����Ti3+�D�DTi4+
Fe3+�D�DFe2+�����ĵ�NH4Fe(SO4)2�����ʵ���Ϊc V/1000,����Ti�����ʵ���ҲΪc V/1000,TiO2������Ϊc
VM/1000,����������Ϊc VM/1000w,(6) ��Ϸ���ʽ2FeTiO3+6C+7Cl2 2FeCl3+ 2TiCl4+6CO������6molCOͬʱʳ��ˮ�������7molCl2����������H2ҲΪ7mol���ɷ���ʽ
2FeCl3+ 2TiCl4+6CO������6molCOͬʱʳ��ˮ�������7molCl2����������H2ҲΪ7mol���ɷ���ʽ
CO(g)��2H2(g)  CH3OH(g)����֪����Ҫ5molH2��
CH3OH(g)����֪����Ҫ5molH2��
���㣺���������⡢�ζ���ȷ������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��
��
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| TiCl4 | Mg | MgCl2 | Ti | |
| �۵�/�� | -25.0 | 648.8 | 714 | 1667 |
| �е�/�� | 136.4 | 1090 | 1412 | 3287 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��ɽ��ʡ�����и�����ѧ����ĩģ�⻯ѧ�Ծ��������棩 ���ͣ������
��12�֣���ұ�������ȼ���״������һ����ҵ������ͼ��ʾ��������������Դ�������ʣ����ٻ�����Ⱦ��

��ش��������⣺
��1��Ti��ԭ������Ϊ22��Tiλ��Ԫ�����ڱ��е�_______���ڣ���______�塣
��2��д���������ڸ������뽹̿���Ȼ��õ����Ȼ��ѵĻ�ѧ����ʽ ��
��3���Ʊ�TiO2�ķ���֮һ������TiCl4ˮ������TiO2��x H2O���پ������Ƶá�ˮ��ʱ����������ˮ�����ȣ����ϻ�ѧ����ʽ�ͱ�Ҫ������˵��ԭ��
��4����TiCl4��Ti ��Ҫ��Ar���н��е�������_________________________________����Ӧ��õ�Mg��MgCl2��Ti�Ļ����ɲ����������ķ�������õ�Ti�������±���Ϣ������ȵ��¶��Ը��� �漴�ɡ�
|
|
TiCl4 |
Mg |
MgCl2 |
Ti |
|
�۵�/�� |
��25.0 |
648.8 |
714 |
1667 |
|
�е�/�� |
136.4 |
1090 |
1412 |
3287 |
��5����������ԭ�ζ����ⶨTiO2������������һ�������£���TiO2�ܽⲢ��ԭΪTi3+������KSCN��Һ��ָʾ������NH4Fe(SO4)2����Һ�ζ�Ti3+��ȫ������Ti4+���ζ�����ʱ����ȡTiO2��Ħ������ΪM g/mol������w g������c mol/L NH4Fe(SO4)2����ҺV mL����TiO2��������Ϊ___________________�����ô���ʽ��ʾ��
��6����CO��H2�ϳɼ״��ķ���ʽ�ǣ�CO(g)��2H2(g) CH3OH(g)���������������� �������ʵ��κ���ʧ��������ҵ����ÿ�ϳ�6mol�״�����������ⲹ��H2 mol��
CH3OH(g)���������������� �������ʵ��κ���ʧ��������ҵ����ÿ�ϳ�6mol�״�����������ⲹ��H2 mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com