
【题目】已知Cl2在70℃的NaOH水溶液中,能发生氧化还原反应后可生成NaClO与NaClO3现有63.9g Cl2,将其通入到足量70℃的NaOH水溶液中,反应完全后测得溶液中NaClO与NaClO3的物质的量比为4:1,并得到500mL溶液。
(1)写出Cl2在70℃的NaOH水溶液中发生上述反应的化学方程式______。
(2)计算完全反应后溶液中NaClO、NaClO3物质的量浓度____、______。
【答案】9Cl2+14NaOH=4NaClO+NaClO3+9NaCl+7H2O 0.8mol/L 0.2mol/L
【解析】
先通过氯元素化合价的对比判断NaClO与NaClO3是氧化产物,氯气得电子化合价降低的产物是还原产物,所以还原产物是氯化钠,根据氧化还原反应中得失电子数相等配平方程式,从而得出反应中被氧化的Cl2与被还原的Cl2的物质的量之比。
(1)该反应中NaClO与NaClO3是氧化产物,氯化钠是还原产物,反应完全后测得溶液中NaClO与NaClO3的物质的量比为4:1,根据氧化还原反应中得失电子数相等配平方程式,所以该方程式为:9Cl2+14NaOH=4NaClO+NaClO3+9NaCl+7H2O;
(2)49.7g Cl2的物质的量为![]() =0.9mol,根据反应9Cl2+14NaOH=4NaClO+NaClO3+9NaCl+7H2O可知,生成NaClO与NaClO3的物质的量分别为
=0.9mol,根据反应9Cl2+14NaOH=4NaClO+NaClO3+9NaCl+7H2O可知,生成NaClO与NaClO3的物质的量分别为![]() 、
、![]() ,完全反应后溶液中NaClO、NaClO3物质的量浓度分别为
,完全反应后溶液中NaClO、NaClO3物质的量浓度分别为![]() 、
、![]() 。
。


科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
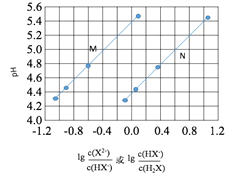
A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度为2 mol/L的HCl溶液VL,欲使其浓度变为4 mol/L,下列方法可行的是( )
A. 通入标准状况下的HCl气体44.8 L
B. 将溶液加热蒸发浓缩至0.5V L
C. 加入10 mol/L盐酸0.6V L,再将溶液稀释至2V L
D. 蒸发掉0.5 L水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的![]() 及泥沙,可将粗盐溶于水,然后进行下列五项操作。正确的操作顺序是( )
及泥沙,可将粗盐溶于水,然后进行下列五项操作。正确的操作顺序是( )
①过滤 ②加过量![]() 溶液 ③加过量盐酸
溶液 ③加过量盐酸
④加热煮沸 ⑤加过量的![]() 溶液 ⑥过量
溶液 ⑥过量![]() 溶液。
溶液。
A.②⑤⑥①③④B.⑤②⑥③①④C.⑥②⑤③④①D.⑥②①⑤③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]
高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:Ⅰ.RCOOR′+ R′′18OH![]() RCO18O R′′+ R′OH(R、R′、R′′代表烃基);
RCO18O R′′+ R′OH(R、R′、R′′代表烃基);
Ⅱ. (R、R′代表烃基);
(R、R′代表烃基);
(1)①的反应类型是________。
(2)②的化学方程式为________。
(3)PMMA单体的官能团名称是________、________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为________。
(5)G的结构简式为________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d.1 mol 与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是________。
(8)写出由PET单体制备PET聚酯(化学式为C10nH8nO4n 或C10n+2H8n+6O4n+2)并生成B的化学方程式________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学教师为“氯气与金属钠反应”设计了如图装置的实验。实验操作:先给钠预热,等钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述中错误的是
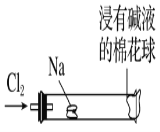
A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气
C.钠着火产生黄色火焰,自然界中存在游离态钠
D.若在棉花球外沿滴一滴石蕊溶液,据其颜色变化判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法不正确的是
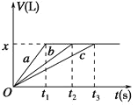
A. x=2.24
B. 三种金属的物质的量均为0.2 mol
C. 反应时,Na、Mg、Al均过量
D. 曲线b为Mg与盐酸反应的图象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水![]() 的制备流程如下:
的制备流程如下:
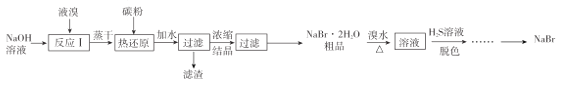
已知:①![]() ;
;
②![]() 溶于
溶于![]() 溶液生成
溶液生成![]() ,离子方程式可表示为
,离子方程式可表示为![]() 。
。
请回答:
(1) “反应I”所用![]() 溶液最好是饱和溶液,理由是____________
溶液最好是饱和溶液,理由是____________
(2)已知“热还原”反应中,氧化剂和还原剂物质的量之比为![]() ,若该反应中消耗了
,若该反应中消耗了![]() 碳粉,则理论上最终可制得
碳粉,则理论上最终可制得![]() 的质量为_____________(不考虑制备过程中的损失)。
的质量为_____________(不考虑制备过程中的损失)。
(3)“脱色”过程中生成了两种强酸,写出该过程的离子方程式:______________________
(4)用![]() 与
与![]() 溶液反应是制备
溶液反应是制备![]() 的另一种方法,反应过程中有气体和沉淀生成,写出此方法的化学方程式:___________________
的另一种方法,反应过程中有气体和沉淀生成,写出此方法的化学方程式:___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com