
【题目】现有浓度为2 mol/L的HCl溶液VL,欲使其浓度变为4 mol/L,下列方法可行的是( )
A. 通入标准状况下的HCl气体44.8 L
B. 将溶液加热蒸发浓缩至0.5V L
C. 加入10 mol/L盐酸0.6V L,再将溶液稀释至2V L
D. 蒸发掉0.5 L水
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式表示的是盐类的水解且正确的是( )
A. HS-+H2O![]() H3O++S2-
H3O++S2-
B. HS-+H+===H2S
C. CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A和气体甲、乙、丙及物质B、C、D、E、F、G,它们之问能发生如下反应,其中乙是黄绿色气体(图中有些反应的产物和反应的条件没有全部标出)。
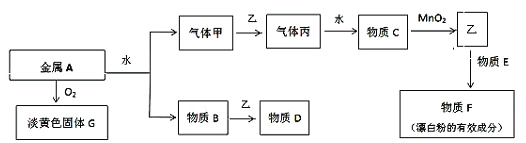
请根据以上信息回答下列问题:
(1)写出下列物质的名称:丙- ;
(2)写出下列物质的化学式:F________________;
(3)气体乙是一种重要的化工原料,在工农业牛产、牛活中有着重要的应用。请你根据所学
知识回答下列问题:
把气体乙通入紫色石蕊溶液中,可以观察到的现象是:__________,请你解释其中的原因 。
某化学兴趣小组计划用气体乙和物质B制取简易消毒液D。其反应原理为:(用化学方程式
表示)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校科学兴趣小组探究二氧化碳与过氧化钠反应是否有氧气生成,设计了下图的实验装置。B中盛有饱和碳酸氢钠溶液,E为收集氧气装置。

(1)写出装置A中发生反应的化学方程式_________。
(2)装置B的作用是_______,发生反应的方程式为_______。
(3)装置C的作用是___________。
(4)写出装置D中发生反应的化学方程式__________。
(5)指出装置E的错误__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列几个装置示意图,有关叙述正确的是( )

A. 装置①工业上可用于生产金属钠,电解过程中石墨电极产生金属。
B. 装置②中阳极产生的气体可以使湿润的淀粉碘化钾试纸变蓝。
C. 装置③中的离子交换膜允许阳离子、阴离子和小分子水通过。
D. 装置④的待镀铁制品应与电源正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立体烷烃中有一系列对称结构的烷烃,如:![]() (正四面体烷C4H4)、
(正四面体烷C4H4)、![]() (棱晶烷C6H6)、
(棱晶烷C6H6)、![]() 立方烷C8H8)等,下列有关说法错误的是
立方烷C8H8)等,下列有关说法错误的是
A. 以此类推分子式为C12H12的立体烷烃的结构应为正六棱柱
B. 上述一系列物质互为同系物,它们的通式为C2nH2n(n≥2)
C. 棱晶烷与立方烷中碳原子均为饱和碳原子,其二氯代物都有三种
D. 苯乙烯(![]() )、环辛四烯(
)、环辛四烯(![]() )与立方烷属于同分异构体
)与立方烷属于同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为______。
(2)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为________。
(4)相同条件下,体积比为a∶b和质量比为a∶b的H2和O2的混合气体,其平均摩尔质量分别是________和________。
(5)在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g,则两种气体的物质的量之和为________mol,CO占总体积的________%。
(6)在某温度时,一定量的元素A的氢化物AH3,在恒温恒压的密闭容器中完全分解为两种气态单质,此时容器的体积变为原来的7/4,则A单质的分子式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出对应方程式:
(1)NaHCO3的电离方程式____
(2)向FeI2溶液中通少量Cl2的离子方程式____
(3)向NaHCO3溶液中逐滴加Ba(OH)2溶液至恰好沉淀完全的离子方程式:___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)是有重要用途的一元弱酸。请回答下列问题:
(1)单质硼溶于热的浓硝酸可以生成硼酸,该反应的化学方程式为___________。
(2)利用铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)制硼酸,已知天然的Fe3O4不溶于酸。生产硼酸的工艺流程如下:

①“浸渣”主要成分的化学式为_____________。
②“净化除杂”:滤液保持一定温度,需先加H2O2溶液,然后再调节溶液的pH=5.6。温度不宜过高的原因是___________。调节溶液的pH=5.6的主要目的是___________。
[已知:Ksp[Fe(OH)3]=2.6×10-39], Ksp[Al(OH)3]=1.3×10-33,
[已知:Ksp[Fe(OH)2]=4.7×10-6], Ksp[Mg(OH)2]=5.6×10-12,

(3)硼酸也可以通过电解方法制备。工作原理如图所示。
①写出阳极的电极反应式___________________。
②a膜或b膜为阳离子交换膜的是________;阴极室溶液的浓度________(填“变大”、“不变”、“变小”)。
(4)写出一定条件下硼酸与氢氧化钠溶液反应的化学方程式_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com