
【题目】下列离子方程式表示的是盐类的水解且正确的是( )
A. HS-+H2O![]() H3O++S2-
H3O++S2-
B. HS-+H+===H2S
C. CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
科目:高中化学 来源: 题型:
【题目】现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol/L的NaOH溶液,乙为0.1 mol/L的HCl溶液,丙为0.1 mol/L的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=__________;
(2)丙溶液中存在电离平衡为_____________、______________(用电离方程式表示);
(3)某同学用甲溶液分别滴定20.00 mL乙溶液和 20.00 mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
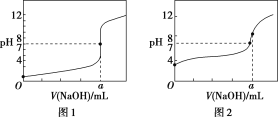
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”);
②a=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向0.1moLH2S溶液中通入HCl气体或加入NaOH固体,测得c(S2-)与溶液pH的关系如图(忽略溶液体积的变化及H2S的挥发)。已知常温下,H2S在水中的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15。下列说法错误的是

A. 当溶液中c(S2-)=1.4×10-19mol/L时,溶液中由水电离出的H+浓度为1.0×10-13mo/L
B. 0.1mo/LNa2S溶液中离子浓度之间的关系为:c(Na+)>c(HS-)+2c(S2-)
C. 常温下,0.1 mol/L NaHS溶液的pH<7
D. 当pH=13时,溶液中的c(H2S)+c(HS-)=0.043mo/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应与能量的说法不正确的是
A.乙醇的燃烧是放热反应
B.Mg与盐酸的反应是吸热反应
C.反应物化学键的断裂要吸收能量
D.化学反应伴随有能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在相应的条件下可能大量共存的是( )
A. 能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+
B. 由水电离产生的c(OH-)=1×10-10mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42-
C. 在![]() =1×10-12的溶液中:NH4+、Fe2+、Cl-、NO3-
=1×10-12的溶液中:NH4+、Fe2+、Cl-、NO3-
D. ![]() =10-10mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
=10-10mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol/L的NaOH溶液,乙为0.1 mol/L的HCl溶液,丙为0.1 mol/L的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=__________;
(2)丙溶液中存在电离平衡为_____________、______________(用电离方程式表示);
(3)某同学用甲溶液分别滴定20.00 mL乙溶液和 20.00 mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:

①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”);
②a=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度为2 mol/L的HCl溶液VL,欲使其浓度变为4 mol/L,下列方法可行的是( )
A. 通入标准状况下的HCl气体44.8 L
B. 将溶液加热蒸发浓缩至0.5V L
C. 加入10 mol/L盐酸0.6V L,再将溶液稀释至2V L
D. 蒸发掉0.5 L水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com