
| A. | 该反应证明了,含最高价元素的化合物,一定具有强氧化性 | |
| B. | 1mol还原剂反应时,转移的电子数为2NA | |
| C. | H2SO4在反应中表现了氧化性和酸性 | |
| D. | 可以利用该反应原理,将它设计成原电池,通过检测电流强度判断司机是否饮酒 |
分析 A.含最高价元素的化合物,不一定具有强氧化性;
B.CH3CH2OH转化为CH3COOH,根据C元素的化合价变化分析;
C.H2SO4中没有化合价的变化;
D.该反应是自发的氧化还原反应,可以设计为原电池.
解答 解:A.含最高价元素的化合物,不一定具有强氧化性,如HCl中H元素为+1价,是最高价,但是HCl没有强氧化性,故A错误;
B.CH3CH2OH转化为CH3COOH,C元素的化合价从-2到0价,1分子CH3CH2OH转移4个电子,则1mol还原剂反应时,转移的电子数为4NA,故B错误;
C.H2SO4中没有化合价的变化,则H2SO4在反应中只表现了酸性,故C错误;
D.该反应是自发的氧化还原反应,可以设计为原电池,当乙醇的浓度越大时,电流越强,所以通过检测电流强度判断司机是否饮酒,故D正确.
故选D.
点评 本题考查了氧化还原反应、原电池原理,题目难度不大,注意从化合价变化的角度分析氧化还原反应,注意把握原电池反应的实质.


科目:高中化学 来源: 题型:选择题
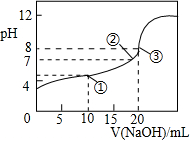 25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )
25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )| A. | ①点时:c(ClO2-)>c(Na+)>c(H+)>c(OH-) | |
| B. | ②点时:c(Na+)=c(ClO2-) | |
| C. | ③点时:c(H+)=c(OH-)+c(HClO2) | |
| D. | 滴定过程中可能出现:c(Na+)>c(ClO2-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时1mL水中含10-10 NA个OH-离子 | |
| B. | 1molCl2通入足量的NaOH溶液中充分反应转移的电子数为2NA | |
| C. | a g某气体含分子数为b,c g该气体在标况下的体积约为22.4bc/(aNA)L | |
| D. | 0.1mol钠和O2在一定条件下反应生成Na2O和Na2O2混合物时,失去电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3与NaOH溶液反应:HCO3-+OH-═CO32-+H2O | |
| B. | 氯气和水反应:Cl2+H2O?2H++Clˉ+ClOˉ | |
| C. | 氯化铁溶液中加入足量的氨水:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+ | |
| D. | 盛放碱性试剂的溶液不能用玻璃塞的原因:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
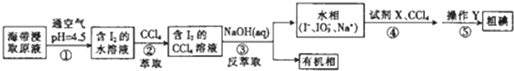
| A. | 步骤②中的萃取过程为物理变化 | |
| B. | 步骤③发生的反应中I2是氧化剂,NaOH是还原剂 | |
| C. | 步骤④所加的试剂X可能是稀硫酸 | |
| D. | 步骤⑤涉及的主要操作Y为分液和蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

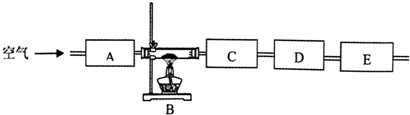
| 仪器 编号 | 药品 | 目的 |
| A | 碱石灰 | |
| B | 绿色固体 | |
| C | ||
| D | ||
| E | 碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .关于它的说法正确的是( )
.关于它的说法正确的是( )| A. | 利尿酸的化学式为:C13H14O4Cl2 | |
| B. | 利尿酸最多可与4 molH2发生反应 | |
| C. | 利尿酸可使溴的四氯化碳溶液褪色 | |
| D. | 利尿酸在一定条件下能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ②④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ⑤②③①⑥④⑦ | B. | ⑤①②③⑥④⑦ | C. | ⑤②①③④⑥⑦ | D. | ⑤③②①⑥④⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com