
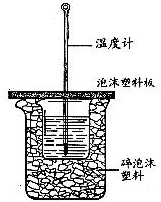
 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1.回答有关中和反应的问题.
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1.回答有关中和反应的问题.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CaO |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
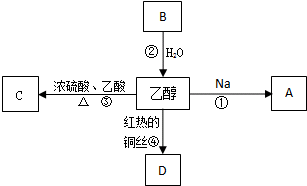 2011年5月1日起,《中华人民共和国刑法修正案(八)》正式实施,醉酒驾驶作为危险驾驶罪被追究驾驶人刑事责任.醉酒驾驶的界定标准为:每百毫升血液中的酒精含量高于或等于80毫克,相当于3两低度白酒或者2瓶啤酒.乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是含碳化合物,其中B是烃.
2011年5月1日起,《中华人民共和国刑法修正案(八)》正式实施,醉酒驾驶作为危险驾驶罪被追究驾驶人刑事责任.醉酒驾驶的界定标准为:每百毫升血液中的酒精含量高于或等于80毫克,相当于3两低度白酒或者2瓶啤酒.乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是含碳化合物,其中B是烃.查看答案和解析>>
科目:高中化学 来源: 题型:
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成; ②球棍模型为 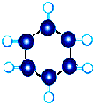 |
| C | ①由C、H、O三种元素组成: ②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2; ②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成; ②其水溶液能使紫色石蕊试液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
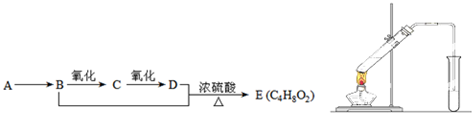
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 取久置的Na2O2粉末,向其中滴加过量的稀硫酸 | 产生无色气体 | Na2O2没有变质 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3.H2O能大量共存 |
| C | 将KI和FeCl3溶液在试管中混合后,加入CCl4震荡,静置 | 下层溶液显紫红色 | 氧化性:Fe2+>I2 |
| D | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有CO32-或HCO3- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com